Karakteristik aktin, struktur, filamen, fungsi
- 2106
- 121
- Ray Thiel
Itu Aktin Itu adalah protein sitosolik yang membentuk mikrofilamen. Dalam eukariota, aktin adalah salah satu protein yang paling berlimpah. Sebagai contoh, itu mewakili 10% berdasarkan berat total protein dalam sel otot; dan antara 1 dan 5% protein dalam sel non -otot.
Protein ini, di sebelah filamen dan mikrotubulus menengah, membentuk sitoskeleton, yang fungsi utamanya adalah mobilitas sel, pemeliharaan bentuk sel, pembelahan sel dan pergerakan organel pada tanaman, jamur dan hewan.
 Sumber: Sarcomere.SVG: David Richfield (Pengguna Slashme) Pekerjaan Derivatif: Retama [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]
Sumber: Sarcomere.SVG: David Richfield (Pengguna Slashme) Pekerjaan Derivatif: Retama [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]] Isoform sitoskelet aktin.
Dari sudut pandang evolusi, aktin adalah protein yang sangat terpelihara. Ada sekitar 90% homologi urutan pada spesies yang berbeda. Pada organisme uniseluler, gen tunggal mengkodekan aktin isaform. Sedangkan dalam organisme multiseluler, gen yang berbeda mengkode beberapa aktin isaforms.
Aktin, bersama dengan myosin, adalah struktur penting dalam masa depan evolusi organisme eukariotik dan diversifikasi mereka, karena mereka mengizinkan gerakan tanpa adanya struktur lain, seperti flagela dan silia.
[TOC]
Struktur: filamen aktin
Actin adalah protein globular rantai polipeptida tunggal. Di otot, aktin memiliki massa molekul sekitar 42 kDa.
Protein ini memiliki dua domain. Masing -masing memiliki dua subdomain, dan sumbing di antara domain. ATP-MG+2 bergabung dengan bagian bawah celah. Terminal amino dan karboksil berkumpul di subdomain 1.
Actina g dan actina f
Ada dua bentuk aktin utama: monomer aktin, yang disebut actina g; dan polimer filamen, terdiri dari monomer actin g, yang disebut actina f. Filamen aktin, diamati dengan mikroskop elektronik, memiliki daerah yang sempit dan lebar, masing -masing berdiameter 7 nm dan 9 nm.
Sepanjang filamen, monomer aktin membentuk helix ganda diperas. Unit yang diulangi di seluruh filamen terdiri dari 13 baling -baling dan 28 monomer aktin, dan memiliki jarak 72 nm.
Filamen aktin memiliki dua tujuan. Salah satu membentuk sumbing yang menghubungkan ATP-MG+2, yang terletak di arah yang sama di semua monomer aktin filamen, yang disebut akhir (-); Dan ujung lainnya adalah sebaliknya, disebut ujung (+). Oleh karena itu, dikatakan bahwa filamen aktin memiliki polaritas.
Sering kali komponen ini dikenal sebagai mikrofilamen, karena mereka adalah komponen sitoskeleton yang menyajikan lebih sedikit diameter.
Di mana kita menemukan aktin?
Actin adalah protein yang sangat umum dalam organisme eukariotik. Dari semua protein sel, aktin mewakili sekitar 5 hingga 10% - tergantung pada jenis sel. Di hati, misalnya, masing -masing sel yang membentuk hampir 5.108 Molekul aktin.
Karakteristik
Dua bentuk aktin, monomer dan filamen terus ditemukan dalam keseimbangan dinamis antara polimerisasi dan depolimer. Secara umum, ada tiga fitur dari fenomena ini:
1) Filamen aktin adalah khas struktur jaringan otot dan sitoskeleton sel eukariotik.
Dapat melayani Anda: 10 karakteristik lipid paling menonjol2) Polimerisasi dan depolimerisasi adalah proses dinamis yang diatur. Dimana polimerisasi atau agregasi monomer aktin G-ATP-MG+2 Itu terjadi di kedua ujungnya. Bahwa proses ini terjadi tergantung pada kondisi medium dan protein pengatur.
3) Pembentukan balok dan reticle, yang membentuk sitoskeleton aktin, memberikan kekuatan pada motilitas sel. Ini tergantung pada protein yang berpartisipasi dalam pembentukan ikatan silang.
Fungsi
Kontraksi otot
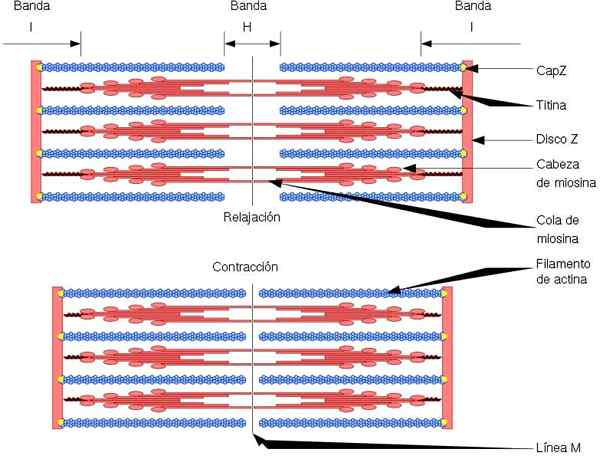
Unit fungsional dan struktural otot rangka adalah sarkomer, yang memiliki dua jenis filamen: filamen tipis, dibentuk oleh aktin, dan filamen tebal, dibentuk oleh myosin. Kedua filamen diatur secara bergantian, dengan cara geometris yang tepat. Izinkan kontraksi otot.
Filamen tipis berlabuh ke daerah yang disebut disk z. Wilayah ini terdiri dari jaringan serat, di mana protein CAPZ berada, dan di mana ujung (+) filamen aktin berlabuh. Jangkar ini mencegah depolerisasi akhir (+).
Di sisi lain, di ujung (-) filamen aktin, tropomodulin berada, dan melindunginya dari depolymersion. Selain aktin, filamen tipis memiliki tropomiosin dan troponin, yang memiliki fungsi pengendalian interaksi akomiosin.
Bagaimana kontraksi otot terjadi?
Selama kontraksi otot, filamen tebal membuat gerakan pivot, dan tarik filamen tipis ke arah tengah sarkomer. Ini menghasilkan geser serat tebal dan tipis.
Dengan demikian, panjang filamen tebal dan tipis tetap konstan, tetapi meningkatkan tumpang tindih antara kedua filamen. Panjang sarkomer berkurang dengan penahan filamen tipis ke cakram z.
Bagaimana kontraksi otot berhenti?
ATP adalah mata uang energi sel. Oleh karena itu, hampir selalu tersedia di jaringan otot hidup. Dengan mempertimbangkan hal -hal di atas, harus ada mekanisme yang memungkinkan relaksasi otot dan penangkapan kontraksi.
Dua protein, yang disebut tropomiosin dan troponin, memiliki peran mendasar dalam fenomena ini. Ini bekerja bersama untuk memblokir situs serikat myosin (sehingga mencegah persatuan mereka dengan aktin). Akibatnya, otot rileks.
Bertentangan, ketika seekor hewan mati mengalami fenomena yang dikenal sebagai mortis rigor. Orang yang bertanggung jawab atas pengerasan tubuh ini adalah blokade interaksi antara myosin dan aktin, tak lama setelah kematian hewan.
Salah satu konsekuensi dari fenomena ini adalah kebutuhan ATP untuk pelepasan dua molekul protein. Secara logis, tidak ada ketersediaan ATP dalam kain mati dan rilis ini tidak dapat terjadi.
Jenis Gerakan Lainnya
Mekanisme yang sama yang kami gambarkan (nanti kami akan memperdalam mekanisme yang mendasari gerakan) tidak terbatas pada kontraksi otot hewan. Dia bertanggung jawab atas gerakan ameboidal yang kami amati di amuba dan dalam beberapa cetakan kolonial.
Dengan cara yang sama, gerakan sitoplasma yang kami amati dalam alga dan tanaman darat dipimpin oleh mekanisme yang sama.
Regulasi polimerisasi dan depolimerisasi filamen aktin
Kontraksi jaringan otot polos dan sel menghasilkan peningkatan aktin F dan penurunan aktin g. Polimerisasi aktin terjadi dalam tiga tahap: 1) nukleasi, langkah lambat; 2) perpanjangan, langkah cepat; dan 3) status stabil. Kecepatan polimerisasi sama dengan tingkat depolimerisasi.
Dapat melayani Anda: teori fixist: konsep, postulat dan penulisFilamen aktin tumbuh lebih cepat pada akhir (+) daripada akhir (-). Kecepatan perpanjangan sebanding dengan konsentrasi monomer aktin dalam keseimbangan dengan filamen aktin, yang disebut konsentrasi kritis (CC).
CC untuk ujung (+) adalah 0,1 μm, dan untuk ujung (-) adalah 0,8 μm. Ini berarti bahwa 8 kali lebih sedikit konsentrasi monomer aktin diperlukan untuk polimerisasi akhir (+).
Polimerisasi aktin terutama diatur oleh penipuan beta4 (TB4). Protein ini menyatukan tindakan dan mempertahankannya, mencegah polimerice. Sementara propylin merangsang polimerisasi aktin. Profil berikatan dengan monomer aktin memfasilitasi polimerisasi pada akhir (+), dengan disosiasi kompleks aktin-TB4.
Faktor -faktor lain seperti peningkatan ion (NA+, K+ atau mg+2) mendukung pembentukan filamen.
Formasi sitoskeleton aktin
Pembentukan sitoskeleton aktin membutuhkan elaborasi ikatan silang antara filamen aktin. Tautan ini membentuk protein, yang highlights adalah: mereka memiliki domain persatuan untuk bertindak; Banyak yang memiliki domain homolog ke calponine; dan setiap jenis protein diekspresikan dalam jenis sel tertentu.
Dalam philopoda dan serat stres, ikatan silang antara filamen aktin dibuat oleh fascin dan philamine. Protein ini, masing -masing, membuat filamen aktin sejajar atau memiliki sudut yang berbeda. Oleh karena itu, filamen aktin menentukan bentuk sel.
Wilayah sel dengan jumlah filamen aktin tertinggi terletak di dekat membran plasma. Wilayah ini disebut korteks. Sitoskeleton kortikal diatur dalam bentuk yang berbeda, tergantung pada jenis sel, dan terhubung ke membran plasma dengan memperbaiki protein.
Beberapa sitoskeleton yang dijelaskan terbaik adalah sel otot, trombosit, sel epitel dan eritrosit. Misalnya, dalam sel otot, protein fiksatif distrofin bergabung dengan filamen aktin ke kompleks glikoproteik yang komprehensif dari membran. Kompleks ini berikatan dengan protein matriks ekstraseluler.
Model Interaksi Actin-Miosin
Peneliti yang dipimpin rayment mengusulkan model empat langkah untuk menjelaskan interaksi aktin dan myosin. Langkah pertama terjadi dengan penyatuan ATP ke kepala myosin. Persatuan ini menghasilkan perubahan konformasi dalam protein, melepaskannya dari aktin dalam filamen kecil.
Kemudian, ATP dihidrolisis ke ADP, melepaskan fosfat anorganik. Molekul myosin berlabuh ke subunit aktin baru, menghasilkan keadaan energi tinggi.
Pelepasan fosfat anorganik membawa perubahan pada myosin, kembali ke konformasi awal dan pergerakan filamen kecil, sehubungan dengan filamen tebal, sehubungan dengan filamen tebal. Gerakan ini menyebabkan pergerakan dua ujung sarkomer, mendekati mereka.
Langkah terakhir melibatkan pelepasan ADP. Pada titik ini kepala myosin gratis dan dapat bergabung dengan molekul ATP baru.
Ini dapat melayani Anda: Biologi: Sejarah, Studi Apa, Cabang, BasisGerakan sel yang didorong oleh polimerisasi aktin
Motilitas rektor adalah jenis motilitas sel. Langkah -langkah dari jenis motilitas ini adalah: proyeksi sumbu adhesi terkemuka ke substrat; adhesi ke substrat; retraksi belakang; dan des-adhesi.
Proyeksi sumbu terkemuka membutuhkan partisipasi protein, yang berpartisipasi dalam polimerisasi dan depolimerisasi filamen aktin. Sumbu terkemuka terletak di korteks sel, yang disebut Lamellipodio. Langkah proyeksi sumbu adalah:
- Aktivasi reseptor dengan sinyal ekstraseluler.
- Formasi GTPASA aktif dan 4,5-biskoposfat fosfoinositol (PIP2).
- Wasp/Scar dan ARP2/3 Aktivasi Protein, yang berikatan dengan monomer aktin untuk membentuk konsekuensi dalam filamen aktin.
- Pertumbuhan filamen aktin yang cepat, pada akhirnya dihiasi dengan myosin, bercabang. Dorongan membran diproduksi ke depan.
- Puncak perpanjangan yang dihasilkan oleh protein penutup.
- Hidrolisis ATP melekat pada aktin di filamen tertua.
- Depolimerisasi aktin-ad dari filamen yang dipromosikan oleh ADF/Cofilina.
- Pertukaran ADP oleh ATP yang dikatalisasi oleh Profilaine, menghasilkan aktin G-ATP yang siap memulai konsekuensi elongar.
Penyakit terkait aktin
Distrofi otot
Distrofi otot adalah penyakit degeneratif otot rangka. Itu diwariskan secara resosi dan dikaitkan dengan kromosom X. Terutama mempengaruhi pria dengan frekuensi tinggi dalam populasi (satu dari 3.500 pria). Ibu -ibu dari pria -pria ini heterozigot tanpa gejala, dan dapat kekurangan riwayat keluarga.
Ada dua bentuk distrofi otot, Duchenne dan Becker, dan keduanya disebabkan oleh cacat pada gen distrofin. Cacat ini terdiri dari penghapusan yang menghilangkan akson.
Dystrophin adalah protein (427 kDa) yang membentuk ikatan silang antara filamen aktin. Ini memiliki penguasaan persatuan untuk bertindak di N-terminal, dan penguasaan persatuan membran di terminal-C. Antara kedua domain ada domain tubular ketiga yang dibentuk oleh 24 pengulangan tandem.
Dalam retikulum kortikal otot, distrofin berpartisipasi dalam penyatuan filamen aktin dengan membran plasma melalui kompleks glikoproteik. Kompleks ini juga berikatan dengan protein matriks ekstraseluler.
Pada pasien yang kekurangan distrofin fungsional, dengan distrofi otot Duchenne, sitoskeleton kortikal tidak mendukung membran plasma. Akibatnya, membran plasma rusak oleh stres kontraksi otot berulang.
Referensi
- Devlin, t.M. 2000. Biokimia. Editorial Reverté, Barcelona.
- Gunst, s.J., dan zhang, w. 2008. Dinamika sitoskeletal aktin pada otot polos: paradigma baru untuk regulasi kontraksi otot polos. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, hlm., Baltimore, d., Darnell, J. 2003. Biologi seluler dan molekuler. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Meksiko, Sāo Paulo.
- Nelson, d. L., Cox, m. M. 2008. Lehninger-prinsip biokimia. W.H. Freeman, New York.
- Pfaendtner, J., Dari salib, dan. M., Voth, g. 2010. Renovasi filamen aktin oleh faktor depolimerisasi aktin/cofilin. PNAS, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Motilitas seluler didorong oleh perakitan dan pembongkaran isi aktin. Sel, 112: 453-465.

