Struktur alkohol tersier, sifat, contoh
- 1922
- 207
- Dewey Runolfsdottir
A Alkohol tersier Ini adalah salah satu di mana kelompok hidroksil, OH, terkait dengan karbon tersier. Formulanya terus menjadi ROH, seperti alkohol lainnya; Tetapi mudah dikenali karena OH dekat dengan x dalam struktur molekul. Juga, rantai berkarbonasi biasanya lebih pendek, dan massa molekul utamanya.
Kemudian, alkohol tersier cenderung lebih berat, lebih bercabang, dan juga paling tidak reaktif sehubungan dengan oksidasi; Artinya, tidak dapat diubah menjadi cetone atau asam karboksilat seperti yang terjadi dengan alkohol sekunder dan primer, masing -masing.
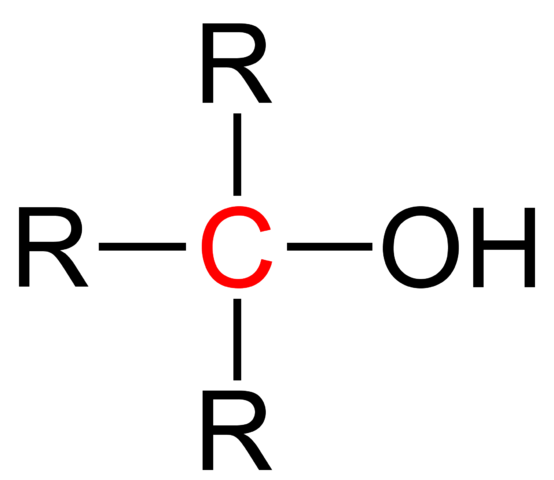
 Formula struktural alkohol tersier. Sumber: Jü [domain publik].
Formula struktural alkohol tersier. Sumber: Jü [domain publik]. Formula struktural umum untuk alkohol tersier ditunjukkan pada gambar atas. Menurutnya, formula jenis R baru dapat ditulis3COH, di mana R bisa menjadi kelompok alkil atau aril; Kelompok metilo, ch3, atau rantai berkarbonasi pendek atau panjang.
Jika ketiga kelompok R berbeda, karbon sentral alkohol tersier akan menjadi kiral; yaitu, alkohol akan menghadirkan aktivitas optik. Untuk fakta ini, alkohol quiral tersier memungut bunga dalam industri farmasi, karena dari keton dengan aktivitas biologis alkohol ini disintesis dengan struktur yang lebih kompleks.
[TOC]
Struktur alkohol tersier
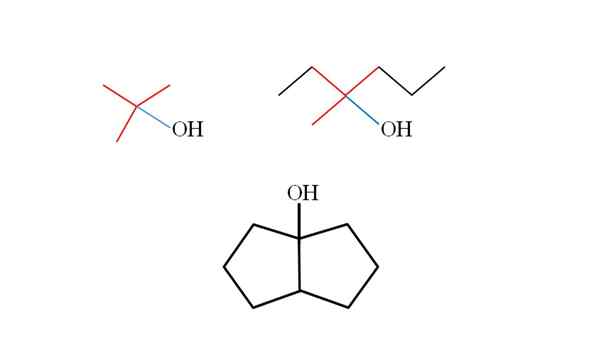 Tiga alkohol tersier dan strukturnya. Sumber: Gabriel Bolívar.
Tiga alkohol tersier dan strukturnya. Sumber: Gabriel Bolívar. Pertimbangkan struktur alkohol tersier atas untuk belajar mengenalinya terlepas dari senyawa. Karbon yang terkait dengan OH juga harus dikaitkan dengan tiga karbon lainnya. Jika diamati secara rinci, tiga alkohol mematuhi ini.
Alkohol pertama (di sebelah kiri), terdiri dari tiga kelompok ch3 Karbon pusat yang terhubung, yang formulasinya akan (cho3)3COH. Grup sewaan (pilih3)3C- dikenal sebagai tertbutil.
Itu dapat melayani Anda: potensiometer (fameter)Alkohol kedua (di sebelah kanan), memiliki karbon pusat lin3, Ch3Ch2 dan ch2Ch2Ch3. Karena ketiga kelompok berbeda, alkohol adalah kiral dan karenanya menunjukkan aktivitas optik. T tidak diamati di sini, tetapi X dekat dengan OH (merah dan biru).
Dan dalam alkohol ketiga (di bawah dan tanpa warna), OH terkait dengan salah satu dari dua karbon yang bergabung dengan dua cyclopentano. Alkohol ini tidak menghadirkan aktivitas optik karena dua kelompok yang terkait karbon pusat identik. Seperti alkohol kedua, jika diamati dengan cermat, X (bukan tetrahedron) juga akan ditemukan.
Hambatan sterik
Tiga alkohol superior memiliki sesuatu yang lebih umum daripada x: karbon sentral dicegah secara sterik; Artinya, ada banyak atom di sekitarnya di luar angkasa. Konsekuensi langsung dari ini adalah bahwa nukleofil, bersemangat untuk muatan positif, mendapatkan kesulitan untuk mendekati karbon ini.
Di sisi lain, memiliki tiga karbon yang terkait dengan karbon pusat, mereka menyumbangkan bagian dari kepadatan elektronik bahwa atom elektronegatif oksigen mengurangi itu, menstabilkannya lebih di depan serangan nukleofilik ini. Namun, alkohol tersier dapat mengalami substitusi dengan membentuk karbokasi.
Properti
Fisik
Alkohol ke -3 umumnya menghadirkan struktur yang sangat bercabang. Konsekuensi pertama dari ini adalah bahwa kelompok OH dicegah, dan oleh karena itu, momen dipolnya memberikan efek kecil pada molekul tetangga.
Ini diterjemahkan ke dalam interaksi molekuler yang lebih lemah dibandingkan dengan alkohol primer dan sekunder.
Dapat melayani Anda: prinsip le châtelierMisalnya, pertimbangkan isomer struktural butanol:
Ch3Ch2Ch2Oh (N-Butanol, PEB = 117ºC)
(Ch3)2Ch2OH (alkohol isobutilik, PEB = 107ºC)
Ch3Ch2Ch (oh) ch3 (Alkohol secbutilic, PEB = 98ºC)
(Ch3)3COH (alkohol tertbutilik, PEB = 82ºC)
Perhatikan bagaimana titik mendidih turun saat isomer menjadi lebih bercabang.
Pada awalnya disebutkan bahwa dalam struktur alkohol 3 dan x diamati, yang dengan sendirinya menunjukkan cabang tinggi. Itulah sebabnya alkohol ini cenderung memiliki titik leleh dan/atau mendidih yang lebih rendah.
Sedikit mirip adalah kasus ketidakmampuan Anda dengan air. Semakin banyak pencegah yang kurang larut OH akan menjadi alkohol 3 dengan air. Namun, ketidakmampuan ini mengurangi semakin lama rantai karbon; Dengan demikian, alkohol termal lebih larut dan larut dengan air daripada N-Butanol.
Keasaman
Alkohol tersier cenderung menjadi asam paling sedikit dari semuanya. Alasannya banyak dan berhubungan satu sama lain. Singkatnya, beban negatif dari alkohol yang diturunkan, merah-, Anda akan merasakan tolakan yang kuat untuk tiga kelompok alkal yang terkait dengan karbon pusat, melemahkan anion.
Semakin tidak stabil anion, semakin sedikit keasaman alkohol.
Reaktivitas
Alkohol ke -3 tidak dapat mengalami oksidasi menjadi keton (r2C = O) atau Aldehydos (RCHO) atau asam karboksilat (RCOOH). Di satu sisi, saya harus kehilangan satu atau dua karbon (dalam bentuk CO2) untuk mengoksidasi, yang mengurangi reaktivitasnya terhadap oksidasi; Dan di sisi lain, ia tidak memiliki hidrogen yang bisa kehilangan untuk membentuk hubungan lain dengan oksigen.
Itu dapat melayani Anda: piridin: struktur, sifat, penggunaan, toksisitas, sintesisNamun, mereka mungkin menderita substitusi dan eliminasi (pembentukan ikatan rangkap, alkena atau olefin).
Tata nama
Nomenklatur untuk alkohol ini tidak berbeda dari yang lain. Ada nama umum atau tradisional, dan nama sistematis yang diatur oleh IUPAC.
Jika rantai utama dan konsekuensinya terdiri dari kelompok sewa yang diakui, itu digunakan untuk nama tradisionalnya; Ketika tidak mungkin untuk melakukannya, nomenklatur IUPAC digunakan.
Misalnya, pertimbangkan alkohol tersier berikut:
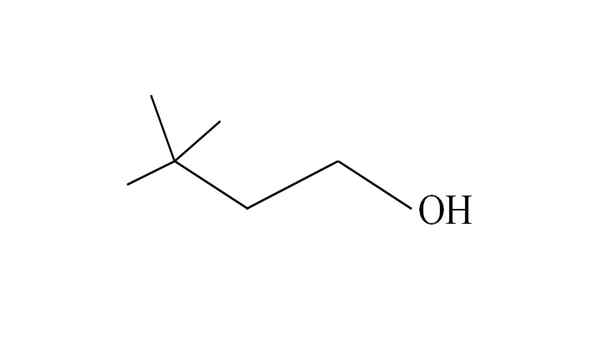 3.3-dimethyl-1-butanol. Sumber: Gabriel Bolívar.
3.3-dimethyl-1-butanol. Sumber: Gabriel Bolívar. Itu mulai menghitung karbon dari kanan ke kiri. Di C-3 ada dua kelompok ch3 substituen, dan oleh karena itu nama alkohol ini adalah 3,3-dimethyl-1-butanol (rantai utama memiliki empat karbon).
Demikian juga, seluruh rantai dan konsekuensinya terdiri dari kelompok neohexilo; Oleh karena itu, nama tradisionalnya bisa neohexyl alkohol, atau neoheksanol.
Contoh
Akhirnya, beberapa contoh alkohol tersier disebutkan:
-2-metil-2-propanol
-3-metil-3-heksanol
-Biciclo [3,3,0] octan-1-ol
-2-metil-2-butanol: ch3Ch2Coh (ch3)2
Rumus dari tiga alkohol pertama diwakili dalam gambar pertama.
Referensi
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. (Edisi ke -5). Editorial Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Gunawardena Gamini. (31 Januari 2016). Alkohol tersier. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Ashenhurst James. (16 Juni 2010). Alkohol (1) - Nomenklatur dan Properti. Dipulihkan dari: Masterorganicchemistry.com
- Clark J. (2015). Memperkenalkan alkohol. Pulih dari: chemguide.bersama.Inggris
- Kimia organik. (S.F.). Tema 3. Alkohol. [PDF]. Pulih dari: Sinorg.Uji.adalah
- Nilanjana Majumdar. (3 Maret 2019). Sintesis alkohol tersier kiral: perkembangan yang signifikan. Pulih dari: 2.Kimia.MSU.Edu
- « Periode formatif Amerika Asal, Karakteristik, Produk
- Bagaimana masyarakat Eropa di paruh pertama abad kesembilan belas »

