Karakteristik, struktur, fungsi Alfa amilasa
- 3769
- 1133
- Pete Lesch
Itu Alfa Amilasa (α-amilase) adalah enzim amilolitik dari kelompok endo amilas yang bertanggung jawab atas hidrolisis ikatan α-1,4 antara residu glukosa yang membentuk berbagai jenis karbohidrat di alam.
Secara sistematis dikenal sebagai secara sistematis dikenal sebagai α-1,4-glukan. Pada manusia, misalnya, amilase yang ada dalam air liur dan yang disekresikan oleh pankreas adalah tipe α-amilase α.
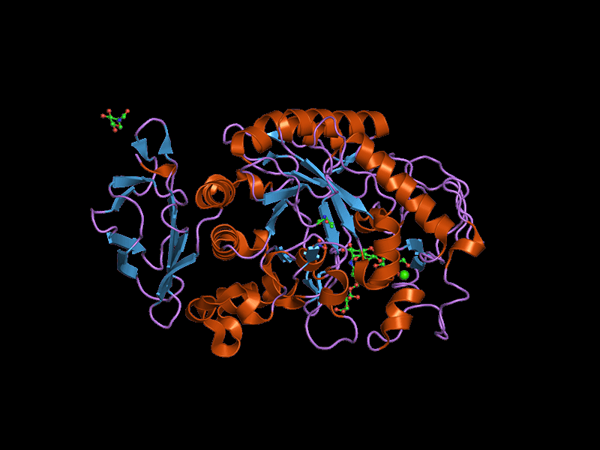
 Struktur domain C-terminal dari hewan Alfa Amilasa (Sumber: Staf Jawahar Swaminathan dan MSD di European Bioinformatics Institute [domain publik] melalui Wikimedia Commons) melalui Wikimedia Commons)
Struktur domain C-terminal dari hewan Alfa Amilasa (Sumber: Staf Jawahar Swaminathan dan MSD di European Bioinformatics Institute [domain publik] melalui Wikimedia Commons) melalui Wikimedia Commons) Kuhn, pada tahun 1925, adalah yang pertama untuk koin istilah "α-amilase" berdasarkan fakta bahwa produk hidrolisis yang mengkatalisasi enzim ini memiliki konfigurasi α. Kemudian, pada tahun 1968 ditentukan bahwa ini lebih disukai bertindak pada substrat konfigurasi struktural linier dan non -branched.
Seperti enzim amilolitik lainnya, α-amilase bertanggung jawab atas hidrolisis pati dan molekul terkait lainnya seperti glikogen, menghasilkan polimer yang lebih kecil yang terdiri dari unit glukosa yang berulang.
Selain fungsi fisiologis yang dimiliki enzim ini pada hewan, tumbuhan dan mikroorganisme yang mengekspresikannya, α-amilase, bersama dengan kelas-kelas lain dari amilase yang ada, mewakili 25% dari enzim yang digunakan untuk tujuan industri dan bioteknologi saat ini.
Banyak spesies jamur dan bakteri adalah sumber utama untuk mendapatkan α-amilase yang lebih sering digunakan dalam industri dan eksperimen ilmiah. Ini terutama karena keserbagunaannya, mudah diperoleh, manajemen sederhana dan biaya rendah terkait dengan produksinya.
[TOC]
Karakteristik
Α-amilase yang ditemukan di alam dapat memiliki rentang pH optimal pH yang sangat berbeda untuk operasinya; Misalnya, optimal untuk hewan α-amilase dan tumbuhan adalah antara 5.5 dan 8.0 unit pH, tetapi beberapa bakteri dan jamur memiliki lebih banyak enzim alkali dan lebih banyak asam.
Dapat melayani Anda: filogeniEnzim yang ada dalam saliva dan pankreas mamalia bekerja lebih baik pada pH mendekati 7 (netral) Selain itu, mereka membutuhkan ion klorida untuk mencapai aktivitas enzimatik maksimum dan dapat bergabung dengan ion kalsium divalen.
Kedua hewan, enzim saliva dan pankreas diproduksi dalam organisme oleh mekanisme independen yang melibatkan sel dan kelenjar tertentu dan yang mungkin tidak terkait dengan enzim yang ada dalam torrent sirkulasi dan rongga tubuh lainnya.
Baik pH dan suhu optimal untuk fungsi enzim ini sangat bergantung pada fisiologi organisme yang dipertimbangkan, karena ada mikroorganisme ekstremofilik yang tumbuh dalam kondisi yang sangat khusus sehubungan dengan ini dan banyak parameter lainnya.
Akhirnya, dalam hal regulasi aktivitasnya, karakteristik yang dibagi antara enzim kelompok α-amilase adalah bahwa ini, seperti amilase lainnya, dapat dihambat oleh ion logam berat seperti merkuri, tembaga, perak dan timah.
Struktur
Α-amylase adalah enzim multidominium yang, pada hewan dan tumbuhan, memiliki perkiraan berat molekul 50 kDa dan penulis yang berbeda sepakat bahwa enzim yang termasuk dalam keluarga glycohydrolesase ini adalah enzim dengan lebih dari sepuluh domain struktural.
Domain pusat atau domain katalitik sangat diawetkan dan dikenal sebagai domain A, yang terdiri dari lipatan simetris dari 8 lembar berlapis β yang diatur dalam bentuk "tong" yang dikelilingi oleh 8 aula alfa, sehingga Anda juga dapat menemukan Dalam literatur bagaimana (β/α) 8 atau "tim" tipe barel.
Penting untuk dicatat bahwa pada ujung C-terminal dari β-lembaran domain A adalah limbah asam amino yang diawetkan yang terlibat dalam katalisis dan di persimpangan substrat dan bahwa domain ini terletak di wilayah terminal-N dari protein.
Itu bisa melayani Anda: fauna dan flora laut PeruDomain lain yang paling banyak dipelajari dari enzim ini adalah apa yang disebut Ding B, yang menonjol di antara lamina berpasir β dan baling-baling alfa nomor 3 dari domain a. Ini memainkan peran mendasar dalam persatuan substrat dan kalsium divalen.
Domain tambahan telah dijelaskan untuk enzim α-amylass, seperti domain c, d, f, g, h dan i, yang terletak di depan atau belakang domain A dan yang fungsinya tidak diketahui dengan tepat dan bergantung pada organisme bahwa itu dipelajari.
α-amilase mikroorganisme
Berat molekul α-amilase tergantung, serta karakteristik biokimia dan struktural lainnya, pada organisme yang dipelajari. Dengan demikian, α-amilase dari banyak jamur dan bakteri memiliki bobot serendah 10 kDa dan setinggi 210 kDa.
Berat molekul tinggi dari beberapa enzim mikroba ini sering terkait dengan adanya glikosilasi, meskipun glikosilasi protein dalam bakteri cukup jarang.
Fungsi
Pada hewan, α-amilase bertanggung jawab atas langkah-langkah pertama dalam metabolisme pati dan glikogen, karena mereka bertanggung jawab atas hidrolisis mereka ke fragmen yang lebih kecil. Organ -organ sistem pencernaan yang bertanggung jawab atas produksinya pada mamalia adalah pankreas dan kelenjar ludah.
In addition to its obvious metabolic function, the production of α-amylases produced by the salivary glands of many mammals, activated by norepinephrine action, is considered by many authors as an important "psychobiological" stress marker in the stress in the central nervous system.
Ini juga memiliki fungsi sekunder dalam kesehatan mulut, karena aktivitasnya bekerja dalam penghapusan bakteri oral dan dalam pencegahan adhesi pada permukaan oral.
Ini dapat melayani Anda: Spesiasi Simpatrik: Konsep, Karakteristik dan ContohFungsi utama pada tanaman
Pada tanaman, α-amilase memainkan peran utama dalam perkecambahan biji, karena mereka adalah enzim yang menghidrolisis pati yang ada dalam endosperma yang memelihara embrio di dalam, proses pada dasarnya dikendalikan oleh gibberelin, fitormon.
Aplikasi Industri
Enzim milik keluarga α-amilase memiliki banyak aplikasi dalam berbagai konteks: industri, ilmiah dan bioteknologi, dll.
Dalam industri pemrosesan pati besar, α-amilase populer digunakan untuk produksi glukosa dan fruktosa, serta untuk produksi roti dengan tekstur yang lebih baik dan dengan kapasitas loyal yang lebih besar.
Di bidang bioteknologi, ada banyak minat mengenai peningkatan enzim yang digunakan secara komersial, untuk meningkatkan stabilitas dan kinerjanya dalam kondisi yang berbeda.
Referensi
- Aiyer, hlm. V. (2005). Amilase dan aplikasinya. Jurnal Bioteknologi Afrika, 4(13), 1525-1529.
- Bernfeld, hlm. (1960). Amlates, A dan B. Di dalam Enzim metabolisme karbohidrat (Vol. I, pp. 149-158).
- Granger, d. KE., Kivighan, k. T., Mereka., Gordis, e. B., & Stud, l. R. (2007). Saliva A-Andlase dalam Penelitian Biobehavioral. Perkembangan dan Aplikasi Terbaru. Ann. N.DAN. Acade. Sci., 1098, 122-144.
- Monteiro, hlm., & Oliveira, P. (2010). Penerapan A-Andlase Mikroba dalam Industri- Tinjauan. Jurnal Mikrobiologi Brasil, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, K. R. S. S. (2003). Tinjauan umum dari keluarga mikroba α-cinta. Jurnal Bioteknologi Afrika, 2(12), 645-648.
- Garam, w., & Shenker, s. (1976). Amylase- Makna klinisnya: Tinjauan literatur. Obat, 55(4), 269-289.
- Svensson, b., & MacGregor, dan. KE. (2001). Hubungan urutan dan struktur dengan spesifisitas dalam keluarga enzim A-amilase A. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, J. KE., Spradlin, J. DAN., & Dygert, s. (1925). Amilase tumbuhan dan hewan. Ann. Chem., 1, 115-189.
- « Struktur renin, produksi, sekresi, fungsi
- Biografi Urie Bronfenbrenner, Model Ekologis dan Kontribusi »

