Amfoter yang adalah, jenis dan contoh
- 4280
- 149
- Ernesto Mueller
Itu Amfostter Mereka adalah senyawa atau ion yang memiliki kekhasan untuk dapat berperilaku sebagai asam atau sebagai basa, menurut teori Bronsted dan Lowry. Namanya berasal dari kata Yunani Amphoteroi, yang berarti "keduanya".
Banyak logam membentuk amfoteros oksida atau hidroksida, termasuk tembaga, seng, timah, timbal, aluminium dan berilium. Karakteristik amfoter oksida ini tergantung pada keadaan oksidasi oksida yang dimaksud. Di akhir artikel contoh zat ini disertakan.

Oksida logam yang dapat bereaksi dengan asam dan basa untuk menghasilkan garam dan air dikenal sebagai amfoteros oksida. Timbal dan seng oksida adalah contoh yang sangat baik, di antara senyawa lainnya.
[TOC]
Apa amfoternya?
Menurut Bronsted dan teori asam-basa Lowry, asam adalah zat yang menyumbangkan proton, sedangkan basa adalah yang menerima atau mengambil proton.
Molekul yang disebut amfotat akan memiliki reaksi di mana ia memperoleh proton, karena juga akan memiliki kemampuan untuk menyumbangkannya (meskipun tidak selalu demikian, seperti yang akan dilihat pada bagian selanjutnya).
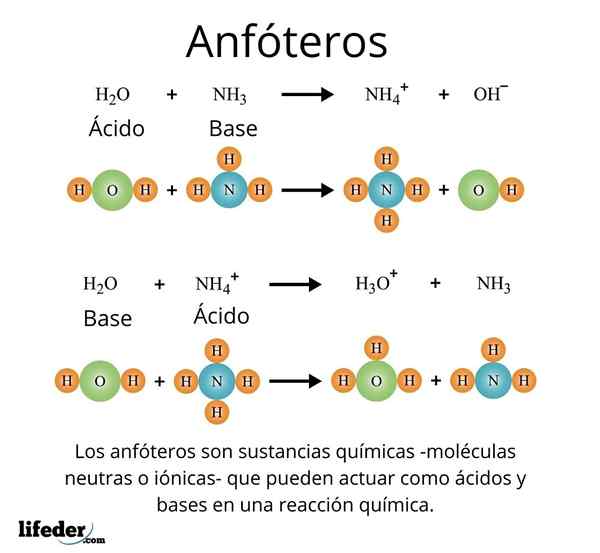
Kasus yang penting dan diakui dengan baik adalah kasus pelarut universal, air (h₂o). Zat ini mudah bereaksi dengan asam, misalnya, sebagai reaksi dengan asam klorida:
H2O + hcl → h3SALAH SATU+ + Cl-
Namun pada gilirannya, ia juga tidak memiliki masalah bereaksi dengan basis, seperti dalam kasus amonia:
H2O + nh3 → NH4 + Oh-
Dengan contoh -contoh ini dapat diamati bahwa air bertindak sepenuhnya sebagai zat amfotasi.
Jenis Amfoter
Meskipun zat amfoten dapat berupa molekul atau ion, ada molekul yang paling menunjukkan karakteristik amfoten dan membantu mempelajari perilaku ini dengan lebih baik: zat amfrofrotik. Ini adalah molekul yang secara khusus dapat menyumbangkan atau menerima proton untuk bertindak sebagai asam atau basa.
Dapat melayani Anda: rodio: sejarah, sifat, struktur, penggunaan, risikoHarus diklarifikasi bahwa semua zat amfotik bersifat amphotik, tetapi tidak semua amfoter adalah amphiprtic; Ada amfotoro yang tidak memiliki proton, tetapi mereka dapat berperilaku sebagai asam atau basa dengan cara lain (seperti teori Lewis).
Di antara zat amphiprtic adalah air, asam amino dan ion bikarbonat dan sulfat. Pada gilirannya, zat amfrofotik juga disubklasifikasi sesuai dengan kemampuan mereka untuk menyumbangkan atau menghasilkan proton:
Zat asam protogenik atau amphiprytic
Adalah mereka yang memiliki kecenderungan lebih besar untuk memberikan proton daripada menerimanya. Di antaranya adalah asam sulfat (h2Sw4) dan asam asetat (CHO3Cooh), antara lain.
Zat protofilik atau amfotik dasar
Mereka adalah mereka yang menerima proton lebih umum daripada menghasilkannya. Di antara zat -zat ini Anda dapat menemukan amonia (NH3) dan ethylendiamide [c2H4(NH2)2].
Zat netral
Mereka memiliki kemudahan atau kemampuan yang sama untuk menerima proton untuk menyerah. Di antaranya adalah air (h2O) dan alkohol kecil (-roh), terutama.
 Karakter quinolones ampotero
Karakter quinolones ampotero Contoh zat amfoten
 Ketegangan Amphotero
Ketegangan Amphotero Sekarang, Anda sudah menggambarkan zat amfoten, perlu untuk menunjukkan contoh reaksi di mana karakteristik ini disajikan.
Ion asam karbonat menyajikan kasus dasar zat amphiprtic; Kemudian reaksi mereka diwakili ketika bertindak sebagai asam:
HCO3- + Oh- → co32- + H2SALAH SATU
Reaksi berikutnya terjadi ketika bertindak sebagai basis:
HCO3- + H3SALAH SATU+ → H2BERSAMA3
Ada juga banyak zat lain. Dari ini adalah contoh berikut:
Amphoteros oksida
Seng oksida, seperti yang telah disebutkan, adalah amfotero tetapi bukan zat amphiprtic. Selanjutnya, itu ditunjukkan mengapa.
Dapat melayani Anda: Justus von LiebigBerperilaku sebagai asam:
ZnO + H2Sw4 → Znso4 + H2SALAH SATU
Berperilaku sebagai basis:
Zno + 2naoh + h2O → na2[Zn (OH)4]
Timbal oksida (PBO), aluminium (AL2SALAH SATU3) dan timah (SNO) juga memiliki karakteristik amfoten sendiri:
Berperilaku seperti asam:
PBO + 2HCL → PBCL2 + H2SALAH SATU
Ke2SALAH SATU3 + 6hcl → 2alcl3 + 3H2SALAH SATU
Sno + hcl ↔ sncl + h2SALAH SATU
Dan sebagai pangkalan:
PBO + 2NAOH + H2O → na2[PB (OH)4]
Ke2SALAH SATU3 + 2NAOH + 3H2O → 2NA [Al (OH)4]
Sno + 4naoh + h2Atau ↔ na4[SN (OH)6]
Ada juga amfoteros oksida dari Gaul, India, skandi, titanium, sirkonium, vanadium, krom, besi, kobalt, tembaga, perak, emas, germanio, antimon, bismuth dan telurio.
Anfoter hidroksida
Hidroksida juga dapat menghadirkan karakteristik amfoten, seperti dalam kasus aluminium hidroksida dan berilium. Kedua contoh diamati di bawah ini:
Aluminium hidroksida sebagai asam:
Al (oh)3 + 3HCL → Alcl3 + 3H2SALAH SATU
Aluminium hidroksida sebagai basis:
Al (oh)3 + NaOH → NA [Al (OH)4]
Beryllium hidroksida sebagai asam:
Jadilah (oh)2 + 2hcl → Becl2 + H2SALAH SATU
Beryllium hidroksida sebagai basis:
Jadilah (oh)2 + 2NAOH → NA2[Be (oh)4]
Perbedaan Antara Amphoteros, Amphiprtic, Ampholites dan Apraticics
Perlu untuk mengetahui cara membedakan konsep setiap istilah, karena kemiripannya bisa menjadi membingungkan.
Diketahui bahwa amfotoro adalah zat yang berperilaku seperti asam atau basa dalam reaksi yang menghasilkan garam dan air. Mereka dapat melakukan ini untuk sumbangan atau penangkapan proton, atau hanya dengan menerima torsi elektronik (atau memberikannya) sesuai dengan teori Lewis.
Di sisi lain, zat amfotik adalah amfoter yang bertindak sebagai asam atau basa dengan sumbangan atau kumpulan proton, menurut hukum Bronsted-Lowry. Semua zat amphotik bersifat amphotik.
Dapat melayani Anda: benzoine: struktur, sifat, penggunaan dan risikoSenyawa ampolitik adalah molekul amfoten yang ada sebagai zwitterion dan memiliki ion dipol pada phye pH tertentu. Mereka digunakan sebagai agen redaman dalam solusi buffer.
Akhirnya, pelarut pemerasan adalah mereka yang tidak memiliki proton untuk menyerah dan juga tidak dapat menerimanya.
Referensi
- Amfoter. (2008). Wikipedia. Diperoleh dari dalam.Wikipedia.org
- Anne Marie Helmestine, P. (2017). Apa arti amfoterik dalam kimia?. Diperoleh dari Thoughtco.com
- BICPUC. (2016). Senyawa amfoterik. Diperoleh dari Medum.com
- Chemicool. (S.F.). Definisi amfoterik. Diperoleh dari chemicool.com.
- « Kolombia khas yang paling populer
- Pilihan topik penelitian bagaimana, pentingnya, contoh dilakukan »

