Anhydrides

- 2937
- 892
- Domingo Gutkowski
Apa itu anhidrida?
Itu Anhydrides Mereka adalah senyawa kimia yang berasal dari penyatuan dua molekul dengan pembebasan air. Dengan demikian, itu dapat dilihat sebagai dehidrasi zat awal; Meskipun itu tidak benar.
Dalam kimia organik dan anorganik, mereka disebutkan, dan di kedua cabang pemahaman mereka berbeda dengan tingkat yang cukup. Sebagai contoh, dalam kimia anorganik dianggap sebagai oksida dasar dan asam seperti anhidri hidroksida dan asam mereka masing -masing, karena yang pertama bereaksi dengan air untuk membentuk yang kedua.
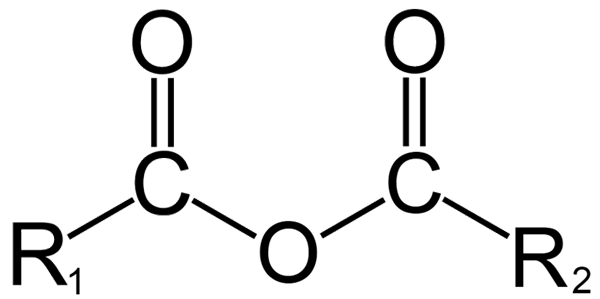 Struktur umum anhidrida. Sumber: Dremmetbrownie [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)], dari Wikimedia Commons
Struktur umum anhidrida. Sumber: Dremmetbrownie [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)], dari Wikimedia Commons Di sini kebingungan antara istilah 'anhidrat' dan 'anhydrido' dapat dihasilkan. Secara umum, anhidrat mengacu pada senyawa yang telah dehidrasi tanpa perubahan sifat kimianya (tidak ada reaksi); Saat dengan anhidrida, ada perubahan kimia, tercermin dalam struktur molekul.
Jika hidroksida dan asam yang sesuai (atau anhidrida) dibandingkan, akan diamati bahwa ada reaksi. Di sisi lain, beberapa oksida atau garam dapat terhidrasi, kehilangan air, dan terus menjadi senyawa yang sama; Tapi, tanpa air, yaitu, anhidros.
Dalam kimia organik, di sisi lain, apa yang dipahami oleh anhydride adalah definisi awal. Sebagai contoh, salah satu anhidrida yang paling terkenal adalah yang berasal dari asam karboksilat (gambar superior). Ini terdiri dari penyatuan dua kelompok asil (-rco) melalui atom oksigen.
Dalam struktur umumnya, R diindikasikan1 Untuk kelompok asil, dan r2 Untuk grup acilo kedua. Karena r1 dan r2 Mereka berbeda, berasal dari asam karboksilat yang berbeda dan kemudian itu adalah asam asimetris anhidrida. Ketika kedua substituen R (apakah aromatik) sama, ada pembicaraan dalam kasus anhidrida asam simetris.
Pada saat menghubungkan dua asam karboksilat untuk membentuk anhidrida, air dapat terbentuk atau tidak, serta senyawa lainnya. Semuanya akan tergantung pada struktur asam ini.
Properti Anhydrid
Sifat anhidrida akan tergantung pada mana yang dimaksud. Hampir setiap orang memiliki kesamaan bahwa mereka bereaksi dengan air. Namun, untuk anhidrida dasar yang disebut SO secara anorganik, beberapa di antaranya bahkan tidak larut dalam air (MGO), sehingga pernyataan ini akan fokus pada anhidrida asam karboksilat karboksilat.
Titik fusi dan didih jatuh pada struktur molekul dan interaksi antarmolekul untuk (RCO)2Atau, ini menjadi formula kimia umum dari senyawa organik ini.
Jika massa molekul (RCO)2Atau rendah, mungkin cairan tidak berwarna pada suhu dan tekanan kamar. Misalnya, anhidrida asetat (atau ehydridge3BERSAMA)2Atau, itu adalah cairan dan kepentingan industri yang paling penting, produksinya sangat luas.
Reaksi antara anhidrida asetat dan air diwakili oleh persamaan kimia berikut:
(Ch3BERSAMA)2Atau + h2O => 2ch3Cooh
Perhatikan bahwa ketika molekul air ditambahkan, dua molekul asam asetat dilepaskan. Reaksi terbalik, bagaimanapun, tidak dapat terjadi untuk asam asetat:
Dapat melayani Anda: keseimbangan uap cair2ch3Cooh => (cho3BERSAMA)2Atau + h2Atau (tidak terjadi)
Perlu untuk menggunakan rute sintetis lainnya. Asam dicarboxilat, di sisi lain, dapat melakukannya dengan memanaskan; Tapi itu akan dijelaskan di bagian selanjutnya.
Reaksi kimia
Hidrolisis
Salah satu reaksi paling sederhana dari anhidrida adalah hidrolisisnya, yang baru saja ditunjukkan untuk anhidrida asetat. Selain contoh ini, ada asam sulfat anhidrida:
H2S2SALAH SATU7 + H2Atau 2H2Sw4
Di sini Anda memiliki anhidrida asam anorganik. Perhatikan bahwa untuk h2S2SALAH SATU7 (juga disebut asam disulfuri), reaksinya reversibel, jadi pemanasan h2Sw4 Konsentrasi hasil dalam pembentukan anhidrida. Jika, di sisi lain, itu adalah larutan h encer2Sw4, Itu dirilis begitu3, Anhidrida sulfur.
Esterifikasi
Asam anhidrida bereaksi dengan alkohol, dengan piridin di tengah, untuk menimbulkan ester dan asam karboksilat. Misalnya, reaksi antara anhidrida asetat dan etanol dipertimbangkan:
(Ch3BERSAMA)2Atau + ch3Ch2Oh => cho3BERSAMA2Ch2Ch3 + Ch3Cooh
Dengan demikian membentuk ester ethyl ethane, ch3BERSAMA2Ch2Ch3, dan asam etana (asam asetat).
Secara praktis, apa yang terjadi adalah penggantian hidrogen gugus hidroksil, oleh kelompok aquilus:
R1-Oh => r1-Ocor2
Dalam kasus (ch3BERSAMA)2Atau, grup asilo Anda adalah -coch3. Oleh karena itu, dikatakan bahwa kelompok OH sedang mengalami akilasi. Namun, akilasi dan esterifikasi bukanlah konsep yang dapat dipertukarkan; Akilasi dapat terjadi langsung di cincin aromatik, yang dikenal sebagai nama asilasi Friedel-Crafts.
Dengan demikian, alkohol dengan adanya asam anhidrida diesterifikasi dengan akilasi.
Di sisi lain, hanya satu dari dua kelompok asam yang bereaksi dengan alkohol, yang lain tetap dengan hidrogen membentuk asam karboksilat; itu dalam kasus (cho3BERSAMA)2Atau, itu adalah asam etanoat.
JAMINGASI
Anhidrida asam bereaksi dengan amonia atau amina (primer dan sekunder), untuk menimbulkan amida. Reaksi ini sangat mirip dengan esterifikasi yang baru dijelaskan, tetapi ROH digantikan oleh amina; Misalnya, amina sekunder, r2NH.
Sekali lagi, reaksi antara (ch3BERSAMA)2Atau dan diethylamine, ET2NH:
(Ch3BERSAMA)2O + 2et2Nh => ch3Lanjutan2 + Ch3Mendekut- +NH2Et2
Dan diethilacetamide terbentuk, cho3Lanjutan2, dan garam amonium karboksilasi, cho3Mendekut- +NH2Et2.
Meskipun persamaannya mungkin tampak agak sulit untuk dipahami, itu cukup untuk mengamati bagaimana kelompok -okoh3 Ganti h dari ET2NH untuk membentuk Amida:
Et2Nh => et2Ncoch3
Lebih dari sekadar jimidasi, reaksinya masih akil. Semuanya dirangkum dalam kata itu; Kali ini, Amina menderita akilasi dan bukan alkohol.
Bagaimana anhidrida?
Anhidrida anorganik dibentuk dengan bereaksi elemen dengan oksigen. Jadi, jika elemennya logam, oksida logam dasar terbentuk; Dan jika tidak metalik, oksida non -metalik atau asam anhidrida terbentuk.
Itu dapat melayani Anda: persamaan clausius-clapeyron: untuk apa, contoh, latihanUntuk anhidrida organik, reaksinya adalah yang lain. Dua asam karboksilat tidak dapat bergabung secara langsung untuk melepaskan air dan membentuk asam anhidrida; Partisipasi senyawa yang belum disebutkan: asil klorida, RCOCL diperlukan.
Asam karboksilat bereaksi dengan asam klorida, menghasilkan anhidrida masing -masing dan hidrogen klorida:
R1Cocl + R2Cooh => (r1Co) atau (cor2) + Hcl
Ch3Cocl + ch3Cooh => (cho3BERSAMA)2O + hcl
A ch3 berasal dari kelompok asetil, cho3Co-, dan yang lainnya sudah ada dalam asam asetat. Pilihan asam spesifik klorida, serta asam karboksilat, dapat menimbulkan sintesis asam simetris atau asimetris anhidrida.
Anhidrida siklik
Berbeda dengan asam karboksilat lain yang membutuhkan asam klorida, asam dikarboksilat dapat mengembun dalam anhidrida yang sesuai. Untuk melakukan ini, perlu memanaskannya untuk mempromosikan pelepasan h2SALAH SATU. Misalnya, pembentukan anhidrida ftalik ditunjukkan dari asam fotal.
 Formasi anhidrida fthalical. Sumber: Jü [domain publik], dari Wikimedia Commons
Formasi anhidrida fthalical. Sumber: Jü [domain publik], dari Wikimedia Commons Perhatikan bagaimana cincin pentagonal selesai, dan oksigen yang bergabung dengan kedua kelompok C = O adalah bagian darinya; Ini adalah anhidrida siklik. Juga dapat dilihat bahwa anhidrida phthalic adalah anhidrida simetris, karena begitu banyak r1 seperti r2 Mereka identik: cincin aromatik.
Tidak semua asam dicarboxilat mampu membentuk anhidrida mereka, karena ketika gugus coOH mereka sangat terpisah, mereka dipaksa untuk menyelesaikan cincin yang semakin besar. Cincin terbesar yang dapat dibentuk adalah heksagonal, lebih besar dari bahwa reaksi tidak terjadi.
Tata nama
Bagaimana nama anhidrida? Mengesampingkan masalah anhidrida organik anorganik, relevan dengan oksida, nama -nama anhidrida organik yang dijelaskan tergantung pada identitas r1 dan r2; yaitu kelompok asil.
Jika keduanya sama, itu cukup untuk menggantikan kata 'asam' dengan 'anhydrid' dengan nama masing -masing asam karboksilat. Dan jika, sebaliknya, keduanya berbeda, mereka dinamai dalam urutan abjad. Oleh karena itu, untuk mengetahui bagaimana menyebutnya Anda harus melihat terlebih dahulu jika itu adalah anhidrida simetris atau asimetris.
Ch3BERSAMA)2Atau simetris, karena r1= R2 = Ch3. Ini berasal dari asam asetat atau etanoik, jadi namanya, mengikuti penjelasan sebelumnya: anhidrida asetat atau etanoik. Hal yang sama terjadi dengan anhidrida fthalic yang baru saja disebutkan.
Misalkan Anda memiliki anhidrida berikut:
Ch3CO (O) Coch2Ch2Ch2Ch2Ch2Ch3
Gugus asetil di sebelah kiri berasal dari asam asetat, dan di sebelah kanan, dari asam heptanoat. Untuk menyebutkan anhidrida ini, Anda harus menunjuk grup R -nya dalam urutan abjad. Jadi, namanya: anhidrida asetat heptanoik.
Aplikasi
Anhidrida anorganik memiliki aplikasi yang tak ada habisnya, dari sintesis dan formulasi bahan, keramik, katalis, semen, elektroda, pupuk, dll., sampai sebagai lapisan kerak bumi dengan ribuan mineral besi dan aluminium, dan karbon dioksida yang dihembuskan oleh organisme hidup.
Dapat melayani Anda: dekantasi: konsep, contoh dan jenisMereka mewakili sumber awal, titik di mana banyak senyawa yang digunakan dalam penurunan sintesis anorganik. Salah satu anhidrida terpenting adalah carbonic, co2. Itu, bersama dengan air, penting untuk fotosintesis. Dan di tingkat industri, SO3 Itu penting karena asam sulfat terdakwa diperoleh darinya.
Mungkin, anhidrida dengan lebih banyak aplikasi dan untuk memiliki (selama ada kehidupan) adalah satu dari asam fosfat: adenosine tryposphate, lebih dikenal sebagai ATP, hadir dalam DNA dan "mata uang energi" dari metabolisme.
Anhidrida organik
Asam anhidrida bereaksi melalui asilasi, baik terhadap alkohol, membentuk ester, amina, menimbulkan amida, atau cincin aromatik.
Ada jutaan senyawa ini, dan ratusan ribu opsi asam karboksilat untuk menyiapkan anhidrida; Oleh karena itu, kemungkinan sintetis tumbuh secara drastis.
Dengan demikian, salah satu aplikasi utama adalah memasukkan gugus asam ke dalam senyawa, menggantikan salah satu atom atau kelompok strukturnya.
Setiap dioksida secara terpisah memiliki aplikasinya sendiri, tetapi secara umum mereka semua bereaksi dengan cara yang sama. Untuk alasan itu, jenis senyawa ini digunakan untuk memodifikasi struktur polimer, menciptakan polimer baru; Artinya, kopolimer, resin, pelapis, dll.
Misalnya, anhidrida asetat digunakan untuk mengencangkan semua gugus OH selulosa (gambar bawah). Dengan ini, masing -masing H dari OH digantikan oleh kelompok asetil, Coch3.
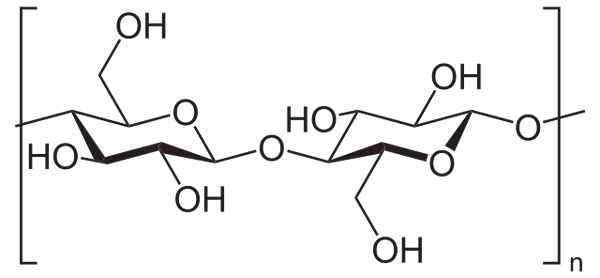 Selulosa. Sumber: Neurotoger [domain publik], dari Wikimedia Commons
Selulosa. Sumber: Neurotoger [domain publik], dari Wikimedia Commons Dengan cara ini polimer selulosa asetat diperoleh. Reaksi yang sama dapat dibuat sketsa dengan struktur polimer lainnya dengan gugus NH2, Juga rentan terhadap akilasi.
Reaksi akilasi ini juga berguna untuk sintesis obat, seperti aspirin (asam asetilSalicylic).
Contoh
Mereka terbukti menyelesaikan beberapa contoh anhidri organik lainnya. Meskipun mereka tidak akan menyebutkannya, atom oksigen dapat digantikan oleh belerang, memberikan anhidrida tersulfur, atau bahkan fosfor.
-C6H5Co (o) masak6H5: Anhydride benzoik. Grup c6H5 mewakili cincin benzena. Hidrolisisnya menghasilkan dua asam benzoat.
-HCO (O) COH: Formic Anhydrid. Hidrolisisnya menghasilkan dua asam format.
- C6H5CO (O) Coch2Ch3: Anhidrida Benzoik. Hidrolisisnya menghasilkan asam benzoik dan propanik.
-C6HsebelasCo (o) masak6Hsebelas: Cyclohexanocroboxylicanight anhydrid. Tidak seperti cincin aromatik, ini jenuh, tanpa tautan ganda.
-Ch3Ch2Ch2CO (O) Coch2Ch3: Anhidrida Butanik Propanooik.
Succinic anhydride
 Succinic anhydride. Sumber: Ninjatacoshell [domain publik], dari Wikimedia Commons
Succinic anhydride. Sumber: Ninjatacoshell [domain publik], dari Wikimedia Commons Di sini Anda memiliki siklik lain, berasal dari asam suksinat, asam dikarboksilat. Perhatikan seperti tiga atom oksigen mengkhianati sifat kimia dari jenis senyawa ini.
Anhydride Maleico sangat mirip dengan suksinat, dengan perbedaan bahwa ada ikatan rangkap antara karbon yang membentuk dasar pentagon.
Anhidrida glutarian
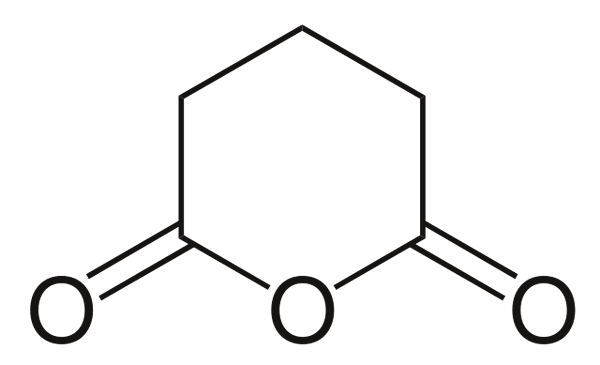 Anhidrida glutarian. Sumber: Choij [domain publik], dari Wikimedia Commons
Anhidrida glutarian. Sumber: Choij [domain publik], dari Wikimedia Commons Dan akhirnya anhidrida asam glutarat ditunjukkan. Ini secara struktural membedakan semua yang lain dengan terdiri dari cincin heksagonal. Sekali lagi, tiga atom oksigen menonjol dalam struktur.
Anhidrida lain yang lebih kompleks selalu dapat dibuktikan dengan tiga atom oksigen yang sangat dekat satu sama lain.
Referensi
- Anhydride. Enclyclopaedia Britannica. Dipulihkan dari: Britannica.com
- Definisi anhidrida asam dalam kimia. Pulih dari: thinkco.com

