Asam anhidrida bagaimana terbentuk, aplikasi dan contoh

- 1603
- 359
- Domingo Gutkowski
Itu asam anhidrida Mereka dianggap sangat penting di antara berbagai senyawa asal organik yang ada. Ini disajikan sebagai molekul yang memiliki dua gugus asam (substituen organik yang formulanya rco-, di mana r adalah rantai karbon) yang disatukan dengan atom oksigen yang sama.
Ada juga kelas asam anhidrida yang umumnya ditemukan: anhidrida karboksilat, disebut karena asam awal adalah asam karboksilat. Untuk menyebutkan jenis ini yang strukturnya simetris, hanya penggantian istilah yang harus dilakukan.

Ekspresi asam harus diganti dalam nomenklatur asam karboksilat aslinya dengan istilah anhidrida, yang berarti "tanpa air", tanpa mengubah sisa nama molekul yang terbentuk. Senyawa ini juga dapat dihasilkan berdasarkan satu atau dua gugus asam dari asam organik lainnya, seperti asam fosfonat atau asam sulfonat.
Demikian pula, asam anhidrida dapat disebabkan berdasarkan asam anorganik, seperti asam fosfat. Namun, sifat fisik dan kimianya, penerapannya dan karakteristik lainnya tergantung pada sintesis yang dilakukan dan struktur anhidrida.
[TOC]
Bagaimana anhidrida asam terbentuk?
Beberapa anhidrida asam berasal dari berbagai cara, baik di laboratorium atau di industri. Dalam sintesis industri, anhidrida asetat diambil sebagai contoh, yang terutama diproduksi oleh proses karbonilasi molekul metil asetat.
Contoh lain dari sintesis ini adalah anhidrida maleico, yang dihasilkan melalui oksidasi molekul benzena atau butana.
Ini dapat melayani Anda: seng hidroksida (Zn (OH) 2)Namun, dalam sintesis asam anihidrida di laboratorium, penekanan ditempatkan pada dehidrasi asam yang sesuai, seperti produksi anhidrida etanik, di mana dua molekul asam ethaic didehidrasi untuk menimbulkan senyawa yang disebutkan.
Dehidrasi intramolekul juga dapat terjadi; Yaitu, dalam molekul asam yang sama dengan dua gugus karboksil (atau dicarboxlic), tetapi jika sebaliknya terjadi dan asam anhidrida menderita hidrolisis, regenerasi asam yang berasal dari itu terjadi.
Asam anhidrida yang substituen asil yang sama, sedangkan dalam anhidrida jenis ini dianggap campuran molekul ini berbeda berbeda.
Namun, spesies ini juga dihasilkan ketika reaksi terjadi antara asam halur (yang formulanya umum adalah (rcox)) dengan molekul karboksilat (yang formulanya umumnya r'coo-)))))))))))))))))))))))))))))))))))))))))))))))))))). [2]
Formula Umum
Formula umum asam anhidrida adalah (RC (O))2Atau, yang lebih baik diamati pada gambar yang ditempatkan di awal artikel ini.
Misalnya, untuk anhidrida asetat (dari asam asetat) formula umum adalah (ch3BERSAMA)2Atau, menulis serupa untuk banyak anhidrida asam serupa lainnya.
Seperti yang dinyatakan di atas, senyawa -senyawa ini memiliki nama asam prekursor yang hampir sama, dan satu -satunya hal yang berubah adalah istilah asam dengan anhidrida, karena aturan penomoran dan substituen yang sama harus diikuti untuk berhasil dengan nomenklatur mereka.
Aplikasi
Asam anhidrida memiliki banyak fungsi atau aplikasi tergantung pada bidang yang sedang dipelajari, karena mereka memiliki reaktivitas tinggi, mereka dapat menjadi reagen prekursor atau menjadi bagian dari banyak reaksi penting.
Dapat melayani Anda: pirolisisContohnya adalah industri, di mana anhidrida asetat diproduksi dalam jumlah besar karena itu adalah struktur paling sederhana yang dapat diisolasi. Anhidrida ini digunakan sebagai reagen organik yang penting, seperti ester asetat.
Penggunaan Industri
Di sisi lain, anhidrida maleico ditunjukkan dengan struktur siklus, digunakan dalam produksi cakupan untuk penggunaan industri dan sebagai prekursor beberapa resin melalui proses kopolimeterisasi dengan molekul stretus. Selain itu, zat ini berfungsi sebagai dienofil ketika reaksi Diels-Alder dilakukan.
Demikian pula, ada senyawa yang memiliki dua molekul anhidrida asam dalam strukturnya, seperti etystarboxylic atau dianhidrida dianhidrida.
Selain itu, ada anhidrida campuran yang disebut 3'-fosfoadenosín-5'-fosfosulfat, dari asam fosfor dan sulfat, yang merupakan koenzim yang paling umum dalam reaksi transfer sulfat biologis sulfat biologis sulfat biologis sulfat biologis sulfat biologis sulfat biologis sulfat biologis sulfat biologis.
Contoh anhidrida asam
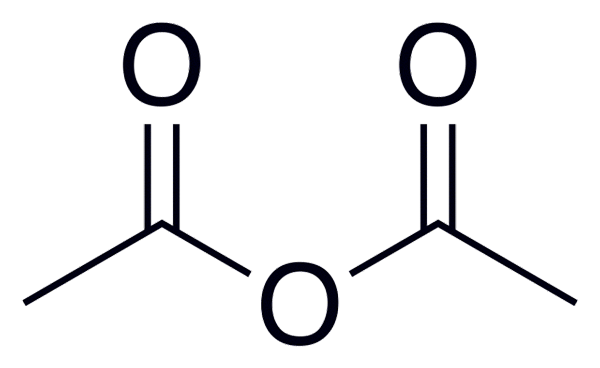 Anhidrida asetat
Anhidrida asetat Di bawah ini adalah daftar dengan nama beberapa anhidrida asam, untuk memberikan beberapa contoh senyawa penting ini dalam kimia organik yang dapat membentuk senyawa struktur linier atau cincin beberapa anggota:
- Anhidrida asetat.
- Anhidrida propanooik.
- Anhydride benzoik.
- Maleico anhydride.
- Succinic anhydride.
- Anhidrida fthalical.
- Dianhydride naphthalente -tracarboxylic.
- Dianhydride Ethytertarboxylic.
- Dianhydride Benzoquinonteterarboxylic.
Sama seperti anhidrida dengan oksigen ini terbentuk, senyawa lain diberikan di mana atom sulfur dapat menggantikan oksigen baik pada gugus karbonil dan oksigen sentral, seperti: misalnya:
Dapat melayani Anda: acetanylide (c8h9no)- Tioacetic anhydride (pilih3C (S)2SALAH SATU)
Bahkan ada kasus dua molekul asam yang membentuk hubungan dengan atom sulfur yang sama; Senyawa ini disebut Tioanhydrides, yaitu:
- Tioanhydride asetat ((CH3BERSAMA))2S)
Referensi
- Wikipedia. (2017). Wikipedia. Diterima dari.Wikipedia.org
- Johnson, a. W. (1999). Undangan Kimia Organik. Pulih dari buku.Google.bersama.pergi.
- Acton, q. KE. (2011). Acid anhydride hydrolas: Kemajuan dalam penelitian dan aplikasi. Pulih dari buku.Google.bersama.pergi
- Bruckner, r., Dan harmata, m. (2010). Mekanisme Organik: Reaksi, Stereokimia dan Sintesis. Pulih dari buku.Google.bersama.pergi
- Kim, J. H., Gibb, h. J., dan Iannucci, untuk. (2009). Anhidrida asam siklik: aspek kesehatan manusia. Pulih dari buku.Google.bersama.pergi

