Jenis Baterai, Karakteristik, dan Reaksi

- 1055
- 57
- Mr. Darrell Streich
Di pasar Anda bisa menjadi berbeda Jenis baterai dengan Karacteristiknya memiliki. Baterai, yang tidak lebih dari sel Volta, memberikan konsumen keuntungan mengambil tempat mana pun (asalkan kondisinya tidak drastis).
Umumnya baterai dapat dibeli terisolasi; Tapi, mereka juga melekat satu sama lain secara seri atau paralel, yang set yang mereka sebut baterai. Dan kadang -kadang istilah 'baterai' dan 'baterai' biasanya digunakan tanpa pandang bulu, bahkan jika mereka tidak sama.
 Baterai Alkaline: Salah satu jenis baterai paling terkenal
Baterai Alkaline: Salah satu jenis baterai paling terkenal Baterai dapat memiliki warna, bentuk, dan ukuran yang tak terhitung banyaknya. Juga, dan yang lebih penting, struktur internal mereka, di mana reaksi kimia yang menghasilkan listrik dikembangkan, berfungsi untuk membedakan mereka dari satu sama lain.
Misalnya, tiga baterai alkaline, salah satu yang paling umum ditunjukkan pada gambar atas. Istilah alkali mengacu pada fakta bahwa media di mana pelepasan dan aliran elektron terjadi adalah dasar; yaitu, memiliki pH lebih besar dari 7 dan anion oh mendominasi- dan biaya negatif lainnya.
[TOC]
Klasifikasi Pilas
Sebelum membahas beberapa jenis baterai, perlu mengetahui bahwa ini diklasifikasikan secara global sebagai primer atau sekunder.
- Baterai utama
Baterai primer adalah yang pernah dikonsumsi, harus dibuang atau didaur ulang, karena reaksi kimia di mana arus listrik dipertahankan tidak dapat diubah. Oleh karena itu, ini tidak dapat diisi ulang.
Mereka terutama digunakan dalam aplikasi di mana tidak praktis untuk mengisi ulang energi listrik; seperti di perangkat militer, di tengah medan perang. Mereka juga dirancang untuk peralatan yang mengonsumsi sedikit energi, sehingga mereka bertahan lebih lama; Misalnya, kendali jarak jauh atau konsol portabel (Gameboy, Tetris dan Tamagotchi).
Baterai alkaline, untuk mengutip contoh lain, juga termasuk jenis primer. Mereka biasanya memiliki bentuk silinder, meskipun ini tidak menyiratkan bahwa baterai silindris tidak dapat sekunder atau diisi ulang.
- Baterai sekunder
Tidak seperti baterai utama, yang sekunder dapat diisi ulang setelah mereka kehabisan energi.
Ini karena reaksi kimia yang terjadi di dalamnya dapat dibalik, dan oleh karena itu, setelah menerapkan tegangan tertentu, itu menyebabkan spesies produk menjadi reagen lagi, untuk memulai reaksi lagi.
Beberapa baterai sekunder (disebut baterai) biasanya kecil, seperti halnya primer; Namun, mereka dialokasikan untuk perangkat yang mengonsumsi lebih banyak energi dan yang penggunaan baterai primer akan secara ekonomi dan energetik. Misalnya, baterai ponsel mengandung baterai sekunder.
Juga, baterai sekunder dirancang untuk peralatan atau sirkuit besar; Misalnya, baterai mobil, yang terdiri dari beberapa baterai atau sel volta.
Mereka biasanya lebih mahal daripada baterai utama dan baterai, tetapi untuk penggunaan jangka panjang mereka akhirnya menjadi pilihan yang lebih tepat dan efektif.
- Aspek lain
Baterai diklasifikasikan baik dalam primer atau sekunder; Tetapi secara komersial atau populer, mereka biasanya diklasifikasikan sesuai dengan bentuk (silindris, persegi panjang, tombol), ke perangkat yang ditakdirkan (kamera, kendaraan, kalkulator), dengan nama mereka (AA, AAA, C, D, N, A23, dll .), Dan kode IEC dan ANSI -nya.
Itu dapat melayani Anda: piridin: struktur, sifat, penggunaan, toksisitas, sintesisJuga, karakteristik seperti tegangannya (1,2 hingga 12 volt), serta masa manfaat dan harga mereka, bertanggung jawab untuk memberikan klasifikasi tertentu di mata konsumen.
Daftar Jenis Tiang
- Baterai karbon-seng
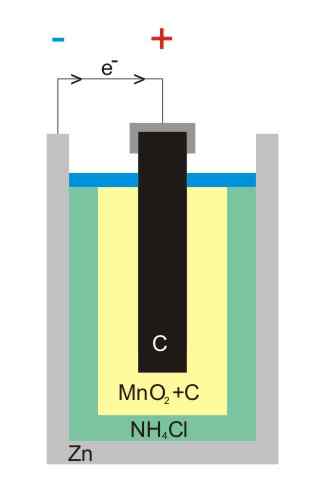 Ilustrasi baterai seng-karbon
Ilustrasi baterai seng-karbon Baterai karbon-seng (juga dikenal sebagai sel Leclanché atau Salinas Pilas) adalah salah satu yang paling primitif, dan saat ini dianggap hampir tidak digunakan di depan baterai lainnya; Terutama, di depan baterai alkaline, yang meskipun mereka sedikit lebih mahal, mereka memiliki waktu seumur hidup dan voltase besar.
Seperti namanya, elektrodanya terdiri dari kaleng seng dan batang grafit, masing -masing sesuai dengan anoda dan katoda.
Dalam elektroda pertama, anoda berasal dari elektron dengan oksidasi seng logam. Elektron ini kemudian menempuh sirkuit eksternal yang memberi makan perangkat dengan listrik, dan kemudian berakhir dalam katoda grafit, di mana siklus selesai ketika dioksida mangan dikurangi di mana ia tenggelam.
Reaksi
Persamaan kimia untuk reaksi yang terjadi dalam elektroda adalah:
Zn (S) → Zn2+(Ac) + 2e- (Anoda)
2 Mno2(s) + 2e- + 2 nh4Cl (ac) → mn2SALAH SATU3(s) + 2 nh3(Ac) + h2Atau (l) + 2 cl- (AC) (katoda)
Baterai ini sangat mirip dengan alkali: keduanya silindris (seperti gambar dari gambar). Namun, baterai karbon-seng dapat dibedakan jika karakteristik berlabel di luar negeri dibaca secara rinci, atau jika kode IEC Anda didahului oleh huruf r. Tegangannya adalah 1,5 V.
- Baterai alkaline
Baterai alkaline sangat mirip dengan jenis karbon-seng, dengan perbedaan bahwa media di mana elektroda mengandung anion OH-. Media ini terdiri dari elektrolit yang kuat dari kalium hidroksida, KOH, yang berkontribusi pada OH- yang berpartisipasi dan "berkolaborasi" dalam migrasi elektron.
Muncul dalam berbagai ukuran dan tegangan, meskipun yang paling umum adalah 1.5V. Mereka mungkin baterai paling terkenal di pasar (Duracell, misalnya).
Reaksi yang terjadi dalam elektroda mereka adalah:
Zn (S) + 2OH-(aq) → zno (s) + h2Atau (l) + 2e- (Anoda)
2mn2(s) + h2Atau (l) + 2e- → Mn2SALAH SATU3(S) + 2OH-(aq) (katoda)
Seiring meningkatnya suhu, reaksi terjadi lebih cepat dan lebih cepat baterai habis. Menariknya, rumor populer dijalankan untuk menempatkan mereka di dalam freezer untuk meningkatkan waktu hidup mereka; Tapi, saat pendinginan, isinya mungkin mengalami kemungkinan solidasi yang membawa cacat atau risiko lebih lanjut.
Air raksa
 Kemungkinan baterai merkuri, yang dapat dikacaukan dengan baterai oksida perak. Sumber: Multicherry [CC0].
Kemungkinan baterai merkuri, yang dapat dikacaukan dengan baterai oksida perak. Sumber: Multicherry [CC0]. Baterai merkuri sangat khas karena rasa malu yang aneh dari kancing perak (gambar superior). Hampir semua orang akan mengenali mereka pada pandangan pertama. Mereka juga basa, tetapi katoda mereka menggabungkan, selain grafit dan mangan dioksida, merkuri oksida, HGO; yang, setelah dikurangi, menjadi Merkuri Logam:
Zn (S) + 2OH-(AC) → ZnO + h2Atau (l) + 2e-
HGO (S) + H2O + 2e- → Hg (s) + 2OH-
Dapat melayani Anda: magnesium oksida: struktur, sifat, nomenklatur, penggunaanPerhatikan bagaimana reaksi sel ini, anion OH dikonsumsi dan diregenerasi-.
Menjadi baterai kecil, dimaksudkan untuk artefak kecil, seperti jam tangan, kalkulator, kontrol mainan, dll. Yang telah menggunakan salah satu dari benda -benda ini akan memperhatikan bahwa tidak perlu mengubah baterai untuk hampir "keabadian"; yang berumur 10 tahun, kira -kira.
Oksida perak
 Baterai oksida perak. Sumber: Lukas A, CZE [Domain Publik].
Baterai oksida perak. Sumber: Lukas A, CZE [Domain Publik]. Cacat utama baterai merkuri adalah bahwa ketika mereka dibuang mereka mewakili masalah serius bagi lingkungan, karena karakteristik toksik dari logam tersebut. Mungkin ini kekurangan kode IEC dan ANSI. Untuk baterai oksida perak, kode IEC -nya didahului oleh huruf S.
Salah satu pengganti baterai merkuri sesuai dengan oksida perak, jauh lebih mahal, tetapi dampak yang lebih sedikit ekologis (citra superior). Di awalnya mereka mengandung merkuri untuk melindungi seng dari korosi alkali.
Ini tersedia dengan tegangan 1.5V, dan aplikasinya sangat mirip dengan Mercury Pila. Bahkan, pada pandangan pertama kedua baterai terlihat identik; Meskipun mungkin ada baterai oksida perak yang jauh lebih besar.
Reaksi dalam elektroda mereka adalah:
Zn (S) + 2OH-(AC) → Zn (OH)2(s) + 2 e-
Ag2Atau + 2h+(Ac) + 2e- → 2ag + h2Atau (l)
Air kemudian menderita elektrolisis, membusuk pada ion H+ dan oh-.
Perhatikan bahwa alih -alih merkuri, itu terbentuk di katoda perak logam.
- Nikel-Kadmium Pilas (NICAD)
 Baterai NICD. Sumber: Lordider [CC0].
Baterai NICD. Sumber: Lordider [CC0]. Dari titik ini, baterai atau baterai sekunder dipertimbangkan. Seperti merkuri, baterai nikel-kadmium berbahaya bagi lingkungan (untuk fauna dan kesehatan) oleh logam kadmium.
Mereka ditandai dengan menghasilkan arus listrik tinggi dan sejumlah besar kali dapat diisi ulang. Faktanya, 2000 kali dapat diisi ulang, yang sama dengan daya tahan yang luar biasa.
Elektrodanya terdiri dari nikel oksida hidroksida, anak (OH), untuk katoda, dan kadmium logam untuk anoda. Yayasan kimia, pada dasarnya, tetap sama: kadmium (bukan seng) kehilangan elektron, dan kadmium nio (OH) memenangkannya.
Reaksi semikel adalah:
CD + 2OH-(AC) → CD (OH)2(s) + 2e-
2nio (OH) + 2H2Atau (l) + 2e- → 2ni (OH)2(s) + oh-(AC)
Oh anion-, Sekali lagi, mereka berasal dari elektrolit koh. Baterai Nicad, kemudian, akhirnya menghasilkan hidroksida logam nikel dan kadmium.
Mereka digunakan secara individual atau digabungkan dalam paket (seperti gambar kuning, superior). Mereka datang, lalu, dalam paket besar atau kecil. Anak -anak kecil menggunakan mainan; Tapi yang besar, ditakdirkan untuk pesawat terbang dan kendaraan listrik.
- Nikel-Hydro Metallic Pilas (Ni-HM)
 Baterai Ni-HM. Sumber: Ramsh Ng dari Flickr (https: // www.Flickr.com/foto/rameshng/5645036051)
Baterai Ni-HM. Sumber: Ramsh Ng dari Flickr (https: // www.Flickr.com/foto/rameshng/5645036051) Baterai atau baterai terkenal lainnya, dan itu melebihi kapasitas energi Nicad, adalah Ni-HM (nikel dan logam hidrida). Itu bisa datang dalam format silindris (baterai konvensional, gambar superior), atau ditambah dalam baterai.
Secara kimia hadir dengan karakteristik yang hampir sama dengan baterai NICAD, dengan perbedaan utama berdasarkan elektroda negatifnya: katoda bukan kadmium, tetapi paduan intermetalik dari tanah jarang dan logam transisi.
Dapat melayani Anda: Rotary Dryer: Operasi, untuk apa, bagian, aplikasiPaduan ini bertanggung jawab untuk menyerap hidrogen yang terbentuk selama beban, menghasilkan logam hidrida kompleks (karenanya huruf H dalam namanya).
Sementara baterai Ni-HM memberikan lebih banyak energi (sekitar 40% lebih banyak), lebih mahal, mereka dipakai lebih cepat, dan tidak dapat dimuat kembali dengan baterai NICAD; yaitu, mereka memiliki waktu hidup yang lebih rendah. Namun, mereka tidak memiliki efek memori (hilangnya kinerja baterai dengan tidak sepenuhnya habis).
Karena alasan inilah mereka tidak boleh digunakan dalam mesin yang bekerja dalam jangka panjang; Meskipun masalah ini telah dikemas dengan baterai LSD-NIHM. Demikian juga, baterai atau baterai Ni-HM memiliki karakteristik termal yang sangat stabil, dapat dioperasikan dalam berbagai suhu tanpa mewakili risiko.
Reaksi
Reaksi yang terjadi dalam elektroda mereka adalah:
Ni (oh)2(s)+ oh-(ac) ⇌ nio (oh) (s) + h2Atau (l) + e-
H2Atau (l) + m (s) + e- ⇌ Oh-(ac)+ mh (s)
- Baterai ion-lisio
 Baterai lithium-ion dari laptop. Sumber: Kristoferb dari Wikipedia.
Baterai lithium-ion dari laptop. Sumber: Kristoferb dari Wikipedia. Di baterai dan baterai lithium mereka didasarkan pada migrasi ion li+, yang ditransfer dari anoda ke katoda, produk dari tolakan elektrostatik dengan muatan positif yang tumbuh.
Beberapa dapat mengisi ulang, seperti baterai laptop (gambar superior), dan lainnya, silindris dan persegi panjang (halus2, Lisocl2 atau limusin2) TIDAK.
Baterai ion-lisio ditandai dengan menjadi sangat ringan dan energi, yang memungkinkan mereka digunakan di banyak perangkat elektronik, seperti smartphone dan peralatan medis. Mereka juga hampir tidak menderita dari efek memori, kepadatan beban mereka melebihi baterai dan baterai NICAD dan NI-HM, dan menunda lebih banyak dalam mengunduh.
Namun, mereka sangat sensitif terhadap suhu tinggi, bahkan meledak; Dan di samping itu, mereka biasanya lebih mahal di depan baterai lainnya. Meski begitu, di pasar baterai lithium terlihat dengan mata yang baik, dan banyak konsumen memenuhi syarat sebagai yang terbaik.
- Baterai timbal asam
 Baterai Baterai Mobil Carf Khas. Sumber: tntflash [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Baterai Baterai Mobil Carf Khas. Sumber: tntflash [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Dan akhirnya, bakteri timbal asam, seperti namanya, tidak mengandung ion OH- tapi h+; Secara khusus, larutan asam sulfat pekat. Sel Volta ada di dalam kotak mereka (gambar atas), di mana tiga atau enam dari mereka dapat digabungkan secara seri, memberikan baterai 6 atau 12 V, masing -masing.
Ini mampu menghasilkan sejumlah besar muatan listrik, dan karena mereka sangat berat, mereka ditakdirkan untuk aplikasi atau perangkat yang tidak dapat diangkut secara manual; Misalnya, mobil, panel surya dan kapal selam. Baterai asam ini adalah yang tertua dan masih berlaku di industri otomotif.
Elektroda Anda terbuat dari timbal: PBO2 Untuk katoda, dan timah logam spons untuk anoda. Reaksi yang terjadi di dalamnya adalah:
Pb (S) +HSO-4(aq) → pbso4(s) +h+(aq) + 2e-
Pbo2(s) +hso-4(aq) + 3h+(aq) + 2e- → PBSO4(S) + 2H2Atau (l)
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Odunlade Emmanuel. (24 Juli 2018). Berbagai jenis baterai dan applacations. Circuit Digest. Dipulihkan dari: CircuitDigest.com
- Prba. (S.F.). Jenis baterai. Pulih dari: prba.org
- Isidor Buchman. (2019). Apa baterai terbaik? Universitas Baterai. Diperoleh dari: BatteryUniversity.com
- Perusahaan McGraw-Hill. (2007). Bab 12: Baterai. [PDF]. Pulih dari: oakton.Edu
- Shapley Patricia. (2012). Jenis Baterai Umum. Universitas Illinois. Pulih dari: butana.Chem.UIUC.Edu
- Sikap ekologis. (22 Januari 2017). Jenis Baterai: Panduan Lengkap Dengan Baterai dan Baterai Yang Ada. Diperoleh dari: Eccological.com
- « Tomás Mejía Biography, Karier Militer, Menembak
- Asam anhidrida bagaimana terbentuk, aplikasi dan contoh »

