Fitur dukungan, fungsi, dan contoh
- 3808
- 241
- Herbert Fritsch
Itu dukungan Mereka adalah bentuk enzim yang tidak aktif, yaitu, mereka adalah enzim yang tidak memiliki kofaktor atau koenzim mereka, yang penting untuk melakukan reaksi katalitik yang mereka lakukan yang bertanggung jawab.
Enzim adalah protein dengan aktivitas katalitik. Fungsinya pada dasarnya mempercepat jalannya berbagai jenis reaksi kimia dalam sel, fakta yang sangat penting untuk keberadaan semua makhluk hidup di bumi.
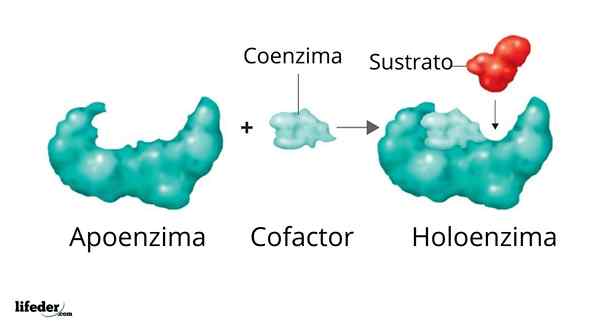
 Holoenzim dibentuk oleh pendukung dan kofaktor/koenzim/kelompok prostetiknya
Holoenzim dibentuk oleh pendukung dan kofaktor/koenzim/kelompok prostetiknya Aktivitas banyak enzim tergantung pada identitas dan pemesanan asam amino yang terdiri dari mereka, yaitu, pada struktur protein mereka sendiri, dan pada integritas struktur ini dalam kondisi kondisi warga asli.
Meskipun ini berlaku untuk banyak enzim, ada beberapa yang membutuhkan elemen non -protein tambahan untuk menjalankan fungsinya. Elemen seperti itu dikenal sebagai Kofaktor, Jika ini adalah ion anorganik, atau Coenzymes, Jika ini adalah molekul kompleks atau organik.
Secara umum, baik kofaktor dan koenzim dikaitkan dengan stabilitas relatif terhadap struktur protein enzim yang aktivitas katalitiknya mempromosikan; Ketika asosiasi ini bersifat permanen (kovalen), kelompok -kelompok ini kemudian dikenal sebagai Kelompok prostetik.
Contoh dukungan
 Ilustrasi 3D DNA polimerase
Ilustrasi 3D DNA polimerase Set enzimatik aktif yang dibentuk oleh protein dengan aktivitas katalitik dan kelompok kofaktor/koenzim/prostetiknya disebut Holoenzyme salah satu enzim terkonjugasi. Dalam holoenzim, bagian protein sesuai dengan apa yang dikenal sebagai mendukung atau apoprotein, yang tidak memiliki aktivitas.
Contoh beberapa dukungan penting adalah:
- Enzim DNA polimerase, bertanggung jawab untuk mereplikasi DNA sel, tanpa ion magnesium divalen yang berfungsi sebagai kofaktor.
- Enzim Karbonat anhidrase, Bertanggung jawab untuk mengkatalisasi konversi CO₂ dan H₂0 menjadi ion bikarbonat dan H+, tanpa ion seng divalen yang berfungsi sebagai kofaktor.
- Enzim hemoglobin, Bertanggung jawab mengangkut oksigen di dalam sel darah merah (eritrosit) oleh darah hewan mamalia, tanpa kelompok prostetik hemo mereka.
- Enzim dehidrogenase laktat, Bertanggung jawab atas produksi laktat dari piruvat, tanpa NADH yang berfungsi sebagai kofaktor.
Karakteristik apoenzim
Dukungannya adalah enzim tidak aktif yang mereka butuhkan, untuk mencapai aktivasi mereka, penyatuan kofaktor atau koenzim, tetapi itu tidak disatukan untuk satu.
Mempertimbangkan ini, dapat dikatakan bahwa molekul semacam itu memiliki karakteristik tertentu, yaitu:
Mereka adalah protein
Tidak seperti kofaktor dan koenzim, yang merupakan elemen non -protein yang diperlukan untuk fungsi holoenzim, dukungan adalah protein.
Pernyataan sebelumnya dipahami, maka, bahwa dukungan dibentuk oleh rantai molekul khusus yang dikenal sebagai asam amino, yang dihubungkan bersama melalui jenis tautan yang dikenal sebagai ikatan peptida.
Urutan asam amino dari masing -masing dukungan ditentukan secara genetik dan ini, pada gilirannya, mengkondisikan tatanan spasial atau tiga dimensi, terkait erat dengan spesifisitas substrat, penyatuan ke kofaktor/koenzim/kelompok prostetik, pembentukan situs aktif, dll.
Seperti protein, apoenzim juga memiliki: muatan listrik, ditentukan oleh kandungan asam amino dan pH media di mana mereka ditemukan; Suhu, pH dan gaya ionik persyaratan karakteristik di mana ia dapat, di hadapan kofaktor, berfungsi pada kecepatan optimal mereka; inhibitor dan pesaing, dll.
Mereka dapat bergabung dengan substrat
Meskipun mereka tidak mampu, dengan sendirinya, untuk mengkatalisasi reaksi enzimatik, banyak pendukung mempertahankan kemampuan untuk bergabung dengan substrat yang berpartisipasi dalam reaksi yang menjadi ciri mereka; Karena alasan ini mereka biasanya digunakan dalam beberapa konteks eksperimental.
Mereka dapat bergabung dengan kofaktor, koenzim atau kelompok prostetik
Dalam kebanyakan kasus, dukungan dapat dianggap sebagai enzim yang tidak aktif siap Untuk bergabung dengan molekul -molekul yang menghadiri fungsinya, yaitu: kepada kofaktor, koenzim atau kelompok prostetik mereka.
Itu bisa melayani Anda: flora dan fauna pantai EkuadorCofactor dapat berpartisipasi langsung dalam reaksi katalitik atau hanya berkontribusi pada stabilisasi struktur umum holoenzim.
Di antara kofaktor utama yang berpartisipasi dalam holoenzim sel adalah:
- Besi (Fe2+)
- Tembaga (Cu2+)
- Kalsium (Ca2+)
- Seng (zn2+)
- Magnesium (MG2)
- Mangan (MN2+)
- Cobalt (CO)
- Nikel (NI)
Di antara koenzim utama dapat ditunjuk:
- Vitamin: B9, B3, C
- Adenosín Triffosphate (ATP)
- Flavín Adenín Dinucleotide (FAD)
- Nicotinamide atau Nicotín Dinucleotide Dycleotide (NAD)
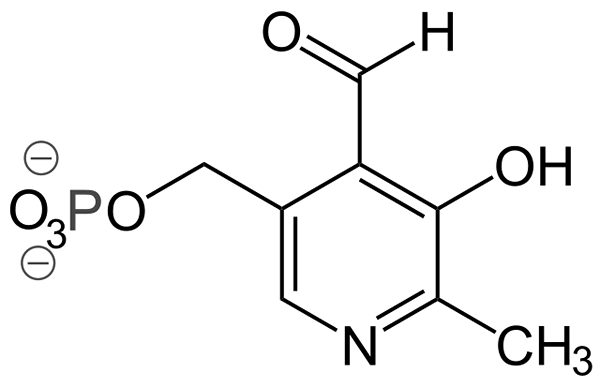 Struktur piridoxal-phosphate (sumber: Ayacop, domain publik, melalui Wikimedia Commons)
Struktur piridoxal-phosphate (sumber: Ayacop, domain publik, melalui Wikimedia Commons) Beberapa kelompok prostetik penting adalah:
- Kelompok hemo
- Biotin
- Tiamin pirofosfat
- Piridoksal-fosfat
Fungsi subenzimas
Karena dukungan adalah bagian protein holoenzim, wajar untuk menganggapnya sebagai bagian terpenting mereka. Bahkan di hadapan koenzim yang sesuai, koenzim dan substrat, tanpa dukungan, tidak ada reaksi enzimatik yang dikatalisis oleh enzim ini dapat dilakukan.
Dalam pengertian ini, fungsi utama dari suatu dukungan adalah untuk menyumbangkan kedua struktur utama holoenzim yang menjadi miliknya, sebagai tempat persatuan untuk kofaktor, koenzim dan/atau kelompok prostetik dan substrat yang berpartisipasi dalam reaksi tersebut.
Dari sudut pandang struktural, holoenzim tanpa apoenzimnya tidak lebih dari kofaktor, dan kofaktor saja tidak lebih dari molekul inert yang relatif (berbicara secara biologis), sehingga dukungannya bertanggung jawab, pada kenyataannya, untuk melaksanakan reaksi katalitik, dibantu oleh elemen non -protein yang disebutkan.
Dapat melayani Anda: actinomycetesDengan demikian, fungsi dukungan, meskipun enzim yang tidak aktif, bergantung pada:
- Rantai linier asam amino atau struktur primer (jika mereka adalah kompleks enzimatik yang dibentuk oleh lebih dari satu subunit, maka itu akan dibahas tentang "rantai linier mereka").
- Cara rantai ini dipesan di luar angkasa, yaitu, struktur sekunder, tersier dan kuaterner, saat kasusnya.
- Konformasi yang tepat dari situs yang mendasar untuk katalisis, yaitu situs katalitik dengan asam amino yang berpartisipasi dalam reaksi, situs serikat untuk co -enzim, koenzim atau kelompok prostetik; dll.
- Stabilitas struktur dalam kondisi sel atau warga asli, Fakta yang berhubungan langsung dengan kemampuan apoenzim untuk membentuk holoenzyme, dan lainnya.
Referensi
- Boyer, hlm. D., & Krebs, dan. G. (1986). Enzim. Pers Akademik.
- Garrett, r. H., & Grisham, C. M. (2001). Prinsip Biokimia: Dengan Fokus Manusia. Perusahaan Penerbitan Brooks/Cole.
- Gruber, k., Puffer, b., & Kräutler, b. (2011). Vitamin B 12-Derivatives-Enzyme Co-Faktor dan Ligan Protein dan Asam Nukleat. Ulasan Masyarakat Kimia, 40 (8), 4346-4363.
- Murray, r. K., Granner, d. K., Mayes, p. KE., & Rodwell, v. W. (2014). Biokimia Illustrated Harper. McGraw-Hill.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip -prinsip biokimia lehninger. Macmillan.
- Staiano, m., Pennacchio, a., VARRIALE, a., Capo, a., Majoli, a., Capacchione, c., & D'Auria, s. (2017). Enzim sebagai sensor. Dalam Metode dalam Enzimologi (Vol. 589, hlm. 115-131). Pers Akademik.
- « Pemohon untuk apa penggunaan, contoh, format (model)
- Napas cabang bagaimana hal itu dilakukan dan contohnya »

