Sejarah Arsenik, Struktur, Properti, Penggunaan

- 4339
- 1151
- Ray Thiel
Dia Arsenik Itu adalah semimetal atau metaloid yang termasuk dalam kelompok 15 atau beralih dari tabel periodik. Itu diwakili oleh simbol kimia sebagai, dan memiliki nomor atom 33. Itu bisa di bawah tiga bentuk alotropik: kuning, hitam dan abu -abu; Yang terakhir menjadi satu -satunya dengan kepentingan industri.
Arsenik abu -abu adalah padatan logam, rapuh -penampilan, dengan warna baja dan kristal (gambar bawah). Kehilangan kecerahannya saat terpapar arsenioso oksida yang membentuk udara (as2SALAH SATU3), yang saat dipanaskan memancarkan aroma bawang putih. Di sisi lain, masing -masing kuning dan hitamnya adalah molekuler dan amorf, masing -masing.
 Arsenik logam. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Arsenik logam. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Arsenik terletak di kerak bumi yang terkait dengan banyak mineral. Hanya sebagian kecil dalam keadaan asli, namun terkait dengan antimon dan perak.
Di antara mineral paling umum di mana arsenik adalah berikut ini adalah: rejalgar (as4S4), oropiment (as2S3), Loellingita (jelek2) dan enargita (Cu3Pantat4). Arsenik juga diperoleh sebagai produk agunan dari pengecoran logam seperti timah, tembaga, kobalt dan emas.
Senyawa arsenik beracun, terutama arsina (abu3). Namun, arsenik memiliki banyak aplikasi industri, termasuk paduan dengan timbal, digunakan dalam elaborasi baterai mobil, dan paduan dengan gallium dengan beberapa kegunaan dalam elektronik.
[TOC]
Sejarah Penemuan Anda
Nama 'arsenik' berasal dari Arsenicum Latin dan Arsenikon Yunani, merujuk pada oropimen kuning, yang merupakan bentuk utama penggunaan arsenik oleh alkemis.
Arsenik jauh sebelum diakui sebagai elemen kimia, diketahui dan digunakan dalam bentuk senyawanya. Misalnya, Aristoteles di abad keempat.C. Dia menulis tentang sandarache, zat yang sekarang dianggap bahwa itu arsenik sulfida.
Plinio El Viejo dan Pivanio Discorides, di abad ke -1.C., Mereka menggambarkan oropiment, mineral yang dibentuk oleh2S3. Pada abad kesebelas, tiga spesies arsenik diakui: putih (as4SALAH SATU4), Kuning (as2S3) dan merah (sebagai4S4).
Arsenik sebagai elemen murni, diamati untuk pertama kalinya oleh Albertus Magnus (1250). Magnus memanaskan arsenik sulfida dengan sabun, memperhatikan penampilan zat dengan karakteristik yang mirip dengan gambar gray abu -abu dari gambar. Namun, laporan otentik pertama isolasi diterbitkan pada tahun 1649 oleh Johann Schroeder, seorang apoteker Jerman.
Schroeder menyiapkan arsenik dengan memanaskan oksida batubaranya. Selanjutnya, Nicolas Lémery berhasil memanaskannya dengan memanaskan campuran arsenik oksida, sabun dan kalium. Pada abad ke -18, elemen ini akhirnya diakui sebagai semimetal.
Itu dapat melayani Anda: tidak ada elektrolit: karakteristik dan contohStruktur arsenik
Arsenik adalah isomorfik untuk antimon; Ini, secara struktural mereka identik, hanya berbeda dalam ukuran atom mereka. Setiap atom arsenik membentuk tiga ikatan as-as kovalen, sedemikian rupa sehingga mereka juga berasal dari unit heksagonal6 "Keriput atau curam", karena hibridisasi sebagai atom adalah SP3.
Lalu unit6 Mereka terhubung sehingga menimbulkan lapisan arsenik yang curam, yang berinteraksi dengan lemah satu sama lain. Mengikuti kekuatan antar molekulnya, terutama tergantung pada massa atomnya, kristal rhomnenic arsenik abu -abu memberikan tekstur padatan yang rapuh dan rapuh.
Mungkin karena tolakan elektron arsenik, unit6 Terbentuk di antara lapisan paralel tidak mendefinisikan octahedron yang sempurna tetapi terdistorsi:
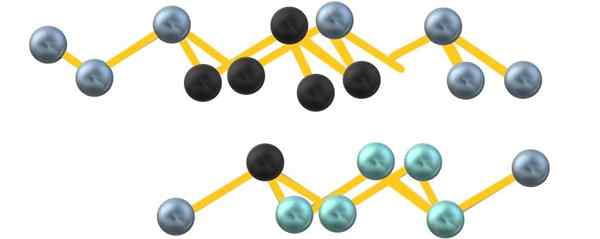 Struktur kristal arsenik abu -abu. Sumber: Gabriel Bolívar.
Struktur kristal arsenik abu -abu. Sumber: Gabriel Bolívar. Perhatikan bahwa bola hitam menggambar bidang yang terdistorsi di ruang antara dua lapisan curam. Juga, di lapisan di bawah ada bola kebiruan yang, di sebelah bola hitam, membentuk unit6 disebutkan di awal bagian.
Struktur terlihat dipesan, baris naik dan turun, dan karenanya kristal. Namun, Anda bisa menjadi amorf, dengan bola yang diperas dengan berbagai cara. Saat arsenik keabu -abuan menjadi amorf, itu menjadi semikonduktor.
Arsenik kuning
Arsenik kuning, alotropik yang paling beracun dari elemen ini, adalah padatan molekul sekadar. Terdiri dari sebagai molekul4 unit oleh kekuatan dispersi yang lemah, yang tidak mencegah mereka menguap.
Arsenik hitam
Arsenik hitam adalah amorf; Tapi tidak bagaimana bisa keagaman keabu -abuan. Strukturnya sedikit mirip dengan yang baru6 Mereka memiliki area yang lebih besar dan pola gangguan yang berbeda.
Konfigurasi elektronik
[Ar] 3d104s24p3
Memiliki semua orbital level 3 penuh. Bentuk tautan menggunakan orbital 4S dan 4P (serta 4D) dengan hibridisasi kimia yang berbeda.
Properti
Berat molekul
74.922 g/mol
Deskripsi Fisik
Grey Arsenic adalah konsistensi yang solid dan rapuh logam keabu -abuan.
Warna
Tiga bentuk alotropik, kuning (alpha), hitam (beta) dan abu -abu (gamma).
Bau
WC
Rasa
Hambar
Titik lebur
1.090 K pada 35,8 ATM (triple arsenic point).
Pada tekanan normal tidak memiliki titik fusi, karena itu menyublimkan 887 k.
Kepadatan
-Arsenik abu -abu: 5,73 g/cm3.
Ini dapat melayani Anda: Grup Karbonil: Karakteristik, Properti, Nomenklatur, Reaktivitas-Arsenik kuning: 1,97 g/cm3.
Kelarutan air
Tidak larut
Radio atom
139 PM
Volume atom
13.1 cm3/mol
Kovalen radio
120 PM
Panas spesifik
0.328 J/G · mol pada 20 ºC
Panas penguapan
32.4 kJ/mol
Elektronegativitas
2,18 pada skala Pauling
Energi ionisasi
Energi ionisasi pertama 946.2 kJ/mol
Keadaan oksidasi
-3, +3, +5
Stabilitas
Arsenik unsur stabil di udara kering, tetapi ketika terkena udara lembab, ditutupi dengan lapisan kuning perunggu yang dapat menjadi lapisan hitam arsenik oksida (2SALAH SATU3).
Penguraian
Saat arsenik dipanaskan untuk dekomposisi, ia mengeluarkan asap putih dari AS2SALAH SATU3. Prosedurnya berbahaya karena Arsina juga dapat dipancarkan, gas yang sangat beracun.
Pengarahan diri sendiri
180 ºC
Kekerasan
3.5 Pada Skala Kekerasan Mohs.
Reaktivitas
Itu tidak diserang oleh asam sulfat dingin atau asam klorida terkonsentrasi. Bereaksi dengan asam nitrat atau asam sulfat panas, membentuk asam arsenous dan asam arsenat.
Saat arsenik abu -abu diuapkan dengan pemanasan, dan uap dengan cepat didinginkan, arsenik kuning terbentuk. Ini kembali ke bentuk keabu -abuan, saat mengalami sinar ultraviolet.
Aplikasi
Paduan
Sejumlah kecil arsenik ditambahkan untuk memimpin, mengeraskan paduannya cukup untuk menggunakannya di lapisan kabel, dan dalam elaborasi baterai mobil.
Penambahan arsenik pada kuningan, paduan tembaga dan seng, meningkatkan ketahanannya terhadap korosi. Di sisi lain, itu memperbaiki atau mengurangi hilangnya seng pada kuningan, yang menyebabkan peningkatan masa manfaatnya.
elektronik
Arsenik murni digunakan dalam teknologi semikonduktor di mana ia digunakan bersama dengan Gallic.
GaA memiliki interval pita langsung, yang dapat digunakan dalam pembuatan dioda, laser dan LED. Selain gallium arseniuro ada arseniuro lainnya, seperti arseniuro India dan aluminium arseniuro, yang juga merupakan semikonduktor II-V II-V.
Sementara itu, kadmium arseniuro adalah semikonduktor tipe II-IV. Arsina telah digunakan dalam doping semikonduktor.
Pertanian dan konservasi kayu
Sebagian besar aplikasi telah dibuang karena toksisitasnya yang luar biasa dan senyawa mereka. As2SALAH SATU3 telah digunakan sebagai pestisida, sedangkan ace2SALAH SATU5 Ini adalah bahan herbisida dan insektisida.
Asam arsenat (h3Aso4) dan garam seperti kalsium dan timbal arsenat, telah digunakan untuk mensterilkan tanah dan mengendalikan hama. Ini menghasilkan risiko polusi lingkungan dengan arsenik.
Dapat melayani Anda: Elemen Cair: Apa itu dan contohLead Arseniato digunakan sebagai insektisida di pohon buah -buahan, sampai paruh pertama abad kedua puluh. Tetapi karena toksisitasnya, itu digantikan oleh natrium methylarsenate, yang berhenti digunakan untuk alasan yang sama sejak 2013.
Obat
Sampai abad kedua puluh beberapa senyawa mereka digunakan sebagai obat -obatan. Arsfenamina dan Neolsalvarsan, misalnya, digunakan dalam pengobatan sifilis dan triposomiasis.
Pada tahun 2000, penggunaan AS disetujui2SALAH SATU3, Senyawa yang sangat beracun, dalam pengobatan janji akut promineo untuk retino-trans-asam asam. Baru -baru ini, isotop radioaktif digunakan 74Adapun lokasi tumor.
Isotop menghasilkan gambar yang bagus, lebih jelas dari yang diperoleh dengan 124Saya, karena yodium dibawa ke tiroid dan menghasilkan kebisingan di sinyal.
Penggunaan lainnya
Arsenik digunakan di masa lalu sebagai pakan aditif dalam produksi unggas dan babi.
Ini digunakan sebagai katalis dalam pembuatan etilena oksida. Ini juga digunakan dalam kembang api dan tan. Arsenioso oksida digunakan sebagai dekolor di manufaktur kaca.
Di mana letaknya?
Arsenik dapat ditemukan dalam jumlah kecil dalam keadaan dasar, dengan tingkat kemurnian yang tinggi. Ini hadir dalam banyak senyawa, seperti: sulfida, arsenuros dan sulfarseniuros.
Ini juga ditemukan di beberapa mineral, termasuk: arsenopyrite (fesas), loellingita (jelek2), enargita (Cu3Pantat4), oropiment (as2S3) Dan Rejalgar (sebagai4S4).
Bagaimana cara diperoleh?
Arsenopirita dipanaskan hingga 650-700 ºC, dengan tidak adanya udara. Arsenik menguap, meninggalkan besi sulfida (fes) sebagai residu. Selama proses ini, arsenik berikatan dengan oksigen untuk terbentuk4SALAH SATU6, dikenal sebagai "Arsenik Putih".
As4SALAH SATU6 Itu dimodifikasi untuk membentuk AS2SALAH SATU3, yang uapnya dikumpulkan dan kental dalam satu set kamera bata, memurnikan arsenik dengan sublimasi.
Sebagian besar arsenik diproduksi dengan mengurangi karbon debu yang terbentuk dari2SALAH SATU3.
Referensi
- Stephen r. Marsden. (23 April 2019). Kimia Arsenik. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (3 Desember 2018). Fakta menarik tentang arsenik. Pulih dari: thinkco.com
- Wikipedia. (2019). Arsenik. Diperoleh dari: di.Wikipedia.org
- Kata. Dough Stewart. (2019). Fakta Elemen Arsenik. Chemicool. Pulih dari: chemicool.com
- Royal Society of Chemistry. (2019). Arsenik. Pulih dari: rsc.Atau
- Para editor Eeritlopaedia Britannica. (3 Mei 2019). Arsenik. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- « Karakteristik Kelompok Minoritas, Jenis, Contoh
- Nomor Reynolds Untuk apa itu, bagaimana itu dihitung, berolahraga »

