Sejarah Benzene, Struktur, Properti, Derivatif, Penggunaan

- 1952
- 150
- Ray Thiel
Dia benzena Ini adalah senyawa organik yang terdiri dari salah satu hidrokarbon aromatik paling sederhana. Formula kimianya adalah C6H6, yang diketahui bahwa hubungan antara karbon dan hidrogen sama dengan 1; yaitu, untuk setiap karbon ada hidrogen yang terkait dengan ini.
Meskipun penampilan fisiknya adalah cairan yang tidak berwarna, secara alami ditemukan dalam minyak dan produk yang berasal dari itu. Bau sangat khas, karena menyerupai campuran lem, bitumen dan bensin; Di sisi lain, itu adalah cairan yang mudah menguap dan mudah terbakar.
 Belfing dengan benzena. Sumber: AIR1404 [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)]
Belfing dengan benzena. Sumber: AIR1404 [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)] Pada gambar atas wadah atau botol dengan benzena ditampilkan, mungkin dari kemurnian non -analitik. Jika uap benzena segera ditemukan di seluruh laboratorium. Untuk alasan ini cairan ini, yang biasa digunakan sebagai pelarut sederhana, dimanipulasi di dalam lonceng ekstraktor gas.
Menjadi Formula C Anda6H6, Bahan kimia abad kesembilan belas mengumpulkan banyak struktur yang mungkin sesuai dengan proporsi tersebut C/H sama dengan 1. Tidak hanya ini, tetapi molekul benzena harus memiliki hubungan khusus sedemikian rupa sehingga stabilitasnya yang tidak biasa dapat dijelaskan dengan reaksi penambahan; Khas untuk alkena dan kebijakan.
Itu agar hubungannya mewakili teka -teki untuk bahan kimia pada waktu itu; Sampai properti dipanggil aromaticity. Sebelum dianggap sebagai hexacyclotriene (dengan tiga ikatan c = c), benzena jauh lebih dari itu, dan itu adalah salah satu contoh sinergi dalam kimia.
Dalam kimia organik, benzena adalah simbol klasik, dasar struktural untuk beberapa senyawa polilaromatik. Dari segi enam, simfin turunan diperoleh melalui substitusi elektrofilik aromatik; Cincin yang ujungnya berbatasan dengan struktur yang mendefinisikan senyawa baru.
Faktanya, turunannya berhutang budi industri yang luas bagi mereka yang membutuhkan benzena di antara bahan baku mereka. Dari persiapan lem tekstil dan serat, hingga plastik, karet, pigmen, obat -obatan dan bahan peledak. Di sisi lain, benzena alami ditemukan di gunung berapi, kebakaran hutan, bensin dan asap rokok.
[TOC]
Sejarah
Penemuan dan nama
Penemuannya berasal dari tahun 1825, biasanya diberikan kepada Michael Faraday, ketika ia mengumpulkan dan melakukan percobaan dengan produk minyak yang tersisa dari gas yang digunakan untuk pencahayaan. Cairan ini mengandung proporsi c/h mendekati 1, itulah sebabnya disebutnya 'hidrogen karburator'.
Kimiawan Auguste Laurent menunjuk 'feno' hidrokarbon aneh, berasal dari kata Yunani 'Phaínein'Apa artinya brilian (karena diperoleh setelah gas terbakar). Namun, nama ini tidak diterima oleh komunitas ilmiah dan hanya berlaku sebagai 'fenil', untuk merujuk pada radikal yang berasal dari benzena.
Dari karet Benzoin, ahli kimia Eilhard Mitscherlich, sembilan tahun kemudian, berhasil menghasilkan senyawa yang sama; Karena itu ada sumber lain untuk hidrokarbon yang sama, yang dibaptis sebagai 'benzina'. Namun, mereka juga tidak mempertimbangkan nama yang tepat untuk mengasumsikan bahwa itu adalah alkaloid, seperti kina.
Dengan demikian, mereka mengganti nama 'Bencina' oleh 'Benzol'. Namun, ada kontradiksi dan perbedaan lagi karena istilah 'benzol' membingungkan hidrokarbon untuk alkohol. Saat itulah nama 'benzene' lahir, digunakan pertama di Prancis dan Inggris.
Itu dapat melayani Anda: lithium karbonat (li2co3): struktur, sifat, penggunaanProduksi industri
Baik gas pencahayaan maupun gusi benzoin tidak ada sumber yang tepat untuk menghasilkan benzena hingga skala besar. Charles Mansfield, bekerja dengan August Wilhelm von Hofmann, dicapai pada tahun 1845 mengisolasi benzena (dua puluh tahun setelah penemuannya) dari Hulla Tar, produk lateral dari produksi kokas.
Dengan demikian, produksi industri benzena dimulai dari tar hulla. Ketersediaan benzena dalam jumlah besar, memfasilitasi studi sifat kimianya dan memungkinkannya menghubungkannya dengan senyawa lain dari reaktivitas serupa yang serupa. August Wilhelm von Hofmann menciptakan kata 'aromatik' untuk benzena dan senyawa terkait.
Struktur sejarah
Mimpi Agustus Kekulé
Friedrich August Kekulé dianugerahi struktur heksagonal dan siklik benzena sekitar tahun 1865, yang muncul dari mimpi aneh dengan Uroboros, ular yang menggigit ekornya sendiri dengan menggambar lingkaran. Dengan demikian, ia percaya bahwa benzena dapat dianggap sebagai cincin heksagonal, dan bahan kimia lain mengangkat struktur yang mungkin, yang ditunjukkan di bawah ini:
 Struktur cincin benzena yang diusulkan sepanjang sejarah. Sumber: Jü [domain publik]
Struktur cincin benzena yang diusulkan sepanjang sejarah. Sumber: Jü [domain publik] Beberapa struktur atas dapat membenarkan stabilitas benzena.
Buku, cincin dan prisma
Perhatikan bahwa struktur ketiga bahkan bukan cincin tetapi prisma segitiga, yang diusulkan oleh Albert Ladenburg pada tahun 1869; Di sebelah kirinya, sebuah buku terbuka -berbentuk, diusulkan oleh Sir James Dewar pada tahun 1867; Dan di sebelah kanannya, satu dengan semua hidrogen diarahkan ke tengah cincin, yang diusulkan oleh Henry Edward Armstrong pada tahun 1887.
Struktur pertama, yang diusulkan oleh Adolf Karl Ludwig Claus pada tahun 1867, juga cukup aneh, karena tautan C-C dilintasi. Dan yang terakhir adalah cincin "Serpentine" Kekulé, bermimpi pada tahun 1865.
Apa "pemenang"? Struktur kelima (dari kiri ke kanan), diusulkan pada tahun 1899 oleh Johannes Thiele.
Dalam hal ini, hibrida resonansi dipertimbangkan untuk pertama kalinya, yang menggabungkan dua struktur Kekulé (memutar cincin pertama di sebelah kanan untuk mengamatinya) dan menjelaskan secara luar biasa relokasi elektron dan, dengan itu, sampai saat itu stabilitas yang tidak biasa dari yang tidak biasa benzena.
Struktur benzena
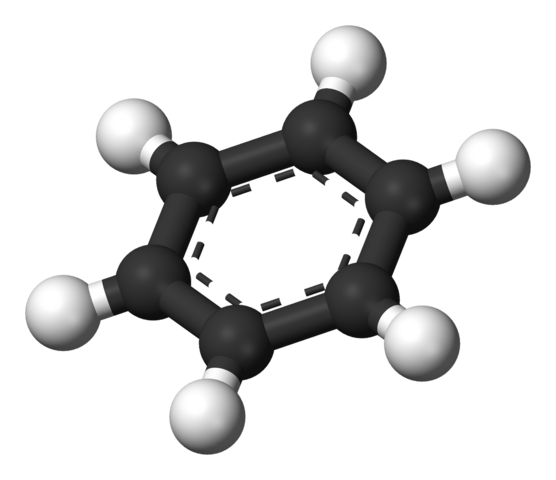 Cincin aromatik benzena. Sumber: Benjah-BMM27 [Domain Publik]
Cincin aromatik benzena. Sumber: Benjah-BMM27 [Domain Publik] Struktur yang diusulkan oleh Thiele ditunjukkan oleh model bola dan batang.
Molekul benzena datar, dengan atom hidrogen menunjuk keluar dari sisi cincin. Semua atom karbon memiliki hibridisasi SP2, Dengan orbital P Tersedia untuk menetapkan sistem aromatik di mana enam elektron pindah.
Carbonos sp2 Mereka lebih elektronegatif daripada hidrogen, dan oleh karena itu, yang pertama menghilangkan kepadatan elektronik ke yang terakhir (cSP2δ--Hδ+). Akibatnya, pusat cincin memiliki konsentrasi elektron yang lebih besar dari sisinya.
Lebih tepatnya, sistem aromatik dapat direpresentasikan sebagai awan atau bantalan elektronik yang melebar oleh kedua sisi cincin heksagonal; dan di tengah, di samping atau tepi, defisiensi elektronik yang dibentuk oleh hidrogen dengan beban parsial positif.
Berkat distribusi muatan listrik ini, molekul benzena dapat berinteraksi satu sama lain melalui pasukan dipol-dipolo; Atom -atom hδ+ Mereka merasakan ketertarikan pada pusat aromatik cincin tetangga (di bawah ini akan diwakili).
Demikian juga, pusat aromatik dapat ditumpuk di atas satu sama lain untuk mendukung induksi dipol instan.
Dapat melayani Anda: AlotropiResonansi
 Struktur dan resonansi hibrida benzena. Sumber: Edgar181 dari Wikipedia.
Struktur dan resonansi hibrida benzena. Sumber: Edgar181 dari Wikipedia. Dua struktur Kekulé ditampilkan di bagian atas gambar, dan di bawahnya, hibrida resonansi. Ketika kedua struktur terjadi lagi dan lagi pada saat yang sama, hibrida diwakili dengan lingkaran yang ditarik di tengah (mirip dengan "donat heksagonal")).
Lingkaran hibrida penting karena menunjukkan karakter aromatik benzena (dan dari banyak senyawa lainnya). Selain itu, ia menunjukkan bahwa tautan tidak selama C-C, atau sesingkat C = C; Tapi panjangnya berada di antara kedua ujungnya. Dengan demikian, benzena tidak dianggap sebagai polyhene.
Di atas telah ditunjukkan oleh pengukuran panjang tautan C-C (139 pm) dari benzena, yang sedikit lebih memanjang daripada ikatan C-H (109 pm).
Kristal
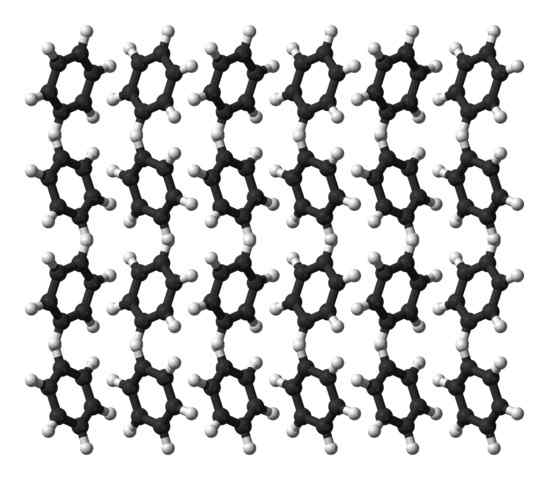 Struktur kristal benzena ortorombik. Sumber: Ben Mills [domain publik]
Struktur kristal benzena ortorombik. Sumber: Ben Mills [domain publik] Benzene adalah cairan pada suhu kamar. Kekuatan antar molekulnya membuat, meskipun memiliki momen dipol yang jelas, ia dapat menyatukan molekulnya dalam cairan yang mendidih pada 80ºC. Ketika suhu turun di bawah 5ºC, benzena mulai membeku: dan dengan demikian kristal yang sesuai diperoleh.
Cincin benzena dapat mengadopsi pola struktural yang didefinisikan dalam padatan mereka. Dipol mereka membuat mereka "miring" ke kiri atau kanan, membentuk peringkat yang mampu direproduksi oleh sel ortrombik ortorm. Dengan demikian, kristal benzena adalah ortorombik.
Catatan pada gambar superior bahwa ketika cincin cenderung mendukung interaksi antara hδ+ dan pusat aromatik, yang disebutkan di sub -bagian sebelumnya.
Properti
Massa molekul
78.114 g/mol.
Penampilan fisik
Cairan tidak berwarna dengan bau yang mirip dengan bensin.
Titik didih
80ºC.
Titik lebur
5.5ºC.
titik pengapian
-11ºC (cangkir tertutup).
Suhu diri sendiri
497.78ºC.
Kepadatan
0,8765 g/ml pada 20ºC.
Kelarutan
Satu liter air mendidih hampir tidak bisa larut 3,94 g benzena. Karakter apolar -nya membuatnya praktis tidak bisa dimusnahkan dengan air. Namun, itu dapat larut dengan pelarut lain, seperti etanol, eter, aseton, minyak, kloroform, karbon tetraklorida, dll.
Kepadatan uap
2.8 dalam hubungan udara (yaitu, hampir tiga kali lebih banyak).
Tekanan uap
94,8 mm Hg pada 25ºC.
Panas pembakaran
-3267.6 kJ/mol (untuk benzena cair).
Panas penguapan
33.83 kJ/mol.
Tegangan permukaan
28,22 mn/m A 25ºC.
Indeks bias
1.5011 hingga 20ºC.
Turunan

Hidrogen benzena dapat diganti dengan kelompok atau atom lain. Mungkin ada satu atau lebih substitusi, meningkatkan tingkat substitusi sampai dari enam hidrogen asli ada.
Misalnya, Benceno sebagai pH-H, di mana H adalah salah satu dari enam hidrogennya. Mengingat bahwa pusat cincin memiliki kepadatan elektronik yang lebih besar, menarik elektrofil, yang menyerang cincin untuk menggantikan H dalam reaksi yang disebut substitusi elektrofilik aromatik (sear).
Jika h ini digantikan oleh OH, ph-oh, fenol akan dimiliki; mengganti cho3, Ph-ch3, Toluena; Jika NH2, Ph-nh2, Anilin; Atau jika itu Cho2Ch3, Ph-ch2Ch3, Ethylbenzene.
Turunannya bisa sama atau lebih beracun daripada benzena, atau sebaliknya, menjadi sangat kompleks sehingga mereka menjadi efek farmakologis yang diinginkan.
Dapat melayani Anda: kalsium karbida (CAC2): struktur, sifat, memperoleh, penggunaanAplikasi
Ini adalah pelarut yang baik untuk berbagai senyawa, ada misalnya dalam lukisan, pernis, perekat dan pelapis.
Ini juga dapat melarutkan minyak, lemak atau lilin, sehingga telah digunakan sebagai pelarut ekstraktor esensi. Properti ini digunakan oleh Ludwig Roselius pada tahun 1903 untuk menghindari kopi, sebuah operasi yang sudah tidak digunakan karena toksisitas benzena. Demikian juga, itu digunakan di masa lalu untuk menurunkan logam.
Dalam salah satu kegunaan klasiknya tidak bertindak sebagai pelarut tetapi sebagai aditif: meningkatkan oktan bensin, menggantikan timah untuk tujuan ini.
Turunan benzena dapat memiliki kegunaan yang berbeda; Beberapa berfungsi sebagai pestisida, pelumas, deterjen, plastik, bahan peledak, parfum, pewarna, lem, obat -obatan, dll. Jika dalam strukturnya ada cincin benzenik, sangat mungkin sintesisnya telah meninggalkan benzena.
Di antara turunannya yang paling penting adalah: cumeno, xylene, anilin, fenol (untuk sintesis resin fenolik), asam benzoat (pengawet), sikloheksan (untuk sintesis nilon), nitrobenzena, resorcinol dan ethylbenzene), nitrobenzene, resorsinol dan etilbenzena).
Tata nama
Nomenklatur turunan benzena bervariasi tergantung pada tingkat substitusi, apa saja kelompok substituen, dan posisi relatifnya. Dengan demikian, benzena dapat menderita monyet, di, tri, tetra, dll., Substitusi
Ketika kedua kelompok terkait dengan karbon yang berdekatan, denominasi 'ortho' digunakan; Jika ada karbon di antara memisahkan mereka, 'tujuan'; Dan jika karbon berada di posisi yang berlawanan, 'untuk'.
Dalam gambar yang lebih rendah, contoh turunan benzena dengan nama masing -masing yang diatur oleh IUPAC ditampilkan. Mereka juga disertai dengan nama umum atau tradisional.
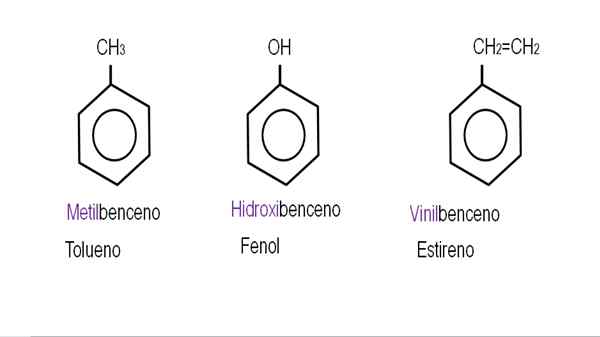 Benzena monoderivasi. Sumber: Gabriel Bolívar.
Benzena monoderivasi. Sumber: Gabriel Bolívar. 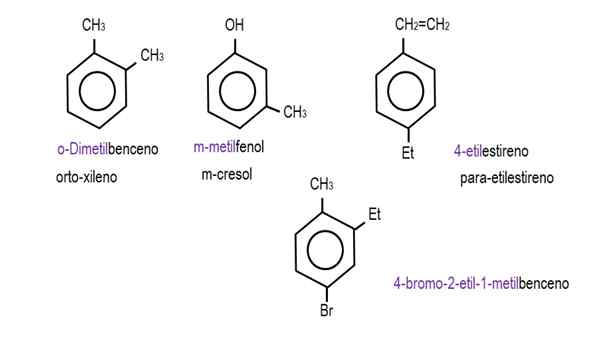 Derivatif benzena lainnya. Sumber: Gabriel Bolívar.
Derivatif benzena lainnya. Sumber: Gabriel Bolívar. Perhatikan bahwa dalam benzena yang secara trikustuat adalah indikator ortho, untuk dan tujuan mereka berhenti bermanfaat.
Toksisitas
Benzena adalah senyawa yang harus dimanipulasi dengan hati -hati. Mengingat bau khususnya, efek negatif langsung bisa mati lemas, pusing, sakit kepala, getaran, kantuk, mual, dan bahkan kematian (sebelum paparan tinggi). Jika, selain apa yang telah disebutkan, nyeri perut dan kejang dapat menyebabkan akut.
Selain itu, efek jangka panjang di bawah paparan konstan terhadap cairan ini adalah karsinogenik; Meningkatkan kemungkinan individu menderita beberapa jenis kanker, terutama darah: leukemia.
Dalam darah dapat mengurangi konsentrasi sel darah merah, menyebabkan anemia, dan juga mempengaruhi sumsum tulang dan hati, di mana ia berasimilasi oleh tubuh untuk menghasilkan turunan benzena yang lebih beracun; Misalnya, hidroksiquinone. Ini juga menumpuk di ginjal, jantung, paru -paru dan otak.
Referensi
- Morrison, r.T. Dan Boyd, R. N. (1987). Kimia organik. (Edisi ke -5). Addison-Wesley Iberoamericana.
- Carey, f. KE. (2008). Kimia organik. (Edisi ke -6). McGraw-Hill, Intermerica, Editor S.KE.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Pusat Nasional Informasi Bioteknologi. (2019). Benzena. Database pubchem. CID = 241, pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2019). Benzena. Diperoleh dari: di.Wikipedia.org
- Garcia Nissa. (2019). Apa itu benzena? - Gunakan, Struktur & Formula. Belajar. Pulih dari: belajar.com
- Pusat Pengendalian dan Pencegahan Penyakit. (4 April 2018). Fakta tentang benzena. Pulih dari: darurat.CDC.Pemerintah
- Organisasi Kesehatan Dunia. (2010). Paparan benzena: masalah kesehatan masyarakat utama. [PDF]. Pulih dari: siapa.int
- Fernández Germán. (S.F.). Masalah nomenklatur benzena. Kimia organik. Pulih dari: chemicicaorganica.org
- « Konsep kosmopolitisme, asal -usul, visi Kant, masyarakat
- Objek geografi turis studi, asal, ilmu tambahan »

