Kalsium bikarbonat

- 770
- 156
- Dewey Runolfsdottir
 Kalsium bikarbonat adalah garam anorganik dari kelompok bikarbonat
Kalsium bikarbonat adalah garam anorganik dari kelompok bikarbonat Apa itu kalsium bikarbonat?
Dia kalsium bikarbonat Ini adalah garam anorganik dengan formula kimia CA (HCO3)2. Ini berasal dari alam dari kalsium karbonat hadir di batu kapur dan batu mineral seperti kalsit.
Kalsium bikarbonat lebih larut dalam air daripada kalsium karbonat. Fitur ini telah memungkinkan pembentukan sistem karst di batu kapur dan dalam penataan gua.
Air tanah yang melintasi retakan jenuh dalam perpindahan karbon dioksida mereka (CO2).
Air ini mengikis batu kapur yang melepaskan kalsium karbonat (caco3) Kalsium bikarbonat itu akan terbentuk, sesuai dengan reaksi berikut:
Maling3(s) +co2(g) +h2Atau (l) => ca (hco3)2(aq)
Reaksi ini terjadi di gua -gua di mana air yang sangat keras berasal. Kalsium bikarbonat tidak dalam keadaan padat tetapi dalam larutan berair, bersama dengan CA2+, Bikarbonat (hco3-) dan ion karbonat (CO32-).
Selanjutnya, dengan mengurangi saturasi karbon dioksida dalam air, reaksi terbalik terjadi, yaitu, transformasi kalsium bikarbonat menjadi kalsium karbonat:
CA (HCO3)2(aq) => co2 (g) +h2Atau (l) +caco3 (S)
Kalsium karbonat sedikit larut dalam air, ini menyebabkan presipitasi terjadi sebagai padatan. Reaksi sebelumnya sangat penting dalam pembentukan stalaktit, stalagmit dan ketebalan lainnya di dalam gua.
Struktur berbatu ini terbentuk dari tetesan air yang jatuh dari langit -langit gua. Caco3 hadir dalam tetes air dikristalisasi untuk membentuk struktur yang disebutkan di atas.
Fakta tidak menemukan kalsium bikarbonat dalam keadaan padat telah menghambat penggunaannya, menemukan beberapa contoh dalam hal ini.
Struktur kalsium bikarbonat
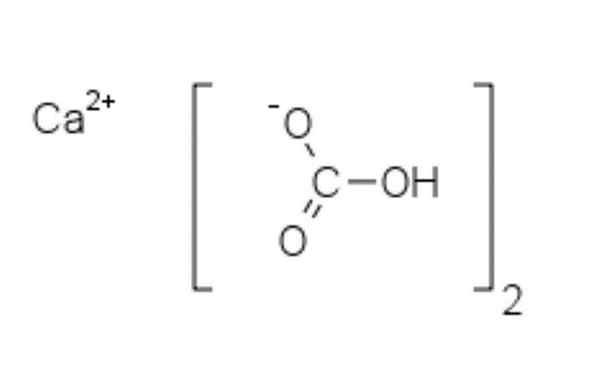 Struktur kimia kalsium bikarbonat
Struktur kimia kalsium bikarbonat Pada gambar atas dua anion HCO ditampilkan3- dan sebuah kation2+ berinteraksi secara elektrostatik. Ca2+, Menurut gambar, itu harus ditempatkan di tengah, karena begitu hco3- Mereka tidak akan mengusir satu sama lain karena tuduhan negatif mereka.
Beban negatif di HCO3- Itu pindah antara dua atom oksigen, dengan resonansi antara kelompok karbonil C = O dan tautan C-O-; sementara di co32-, Ini dipindahkan antara tiga atom oksigen, karena ikatan C-O tidak terlindungi dan dapat menerima beban resonansi negatif.
Itu bisa melayani Anda: difenilaminGeometri ion -ion ini dapat dianggap sebagai bola kalsium yang dikelilingi oleh segitiga karbonat datar dengan ujung yang terhidrogenasi. Dalam hal rasio ukuran, kalsium jauh lebih kecil dari ion HCO3-.
Solusi berair
Kalsium bikarbonat Anda tidak dapat membentuk padatan kristal, dan itu benar -benar terdiri dari larutan air dari garam ini. Di dalamnya, ion tidak sendirian, seperti pada gambar, tetapi dikelilingi oleh molekul H2SALAH SATU.
Setiap ion dikelilingi oleh bola hidrasi, yang akan tergantung pada logam, polaritas dan struktur spesies terlarut.
Ca2+ Ini berkoordinasi dengan atom oksigen air untuk membentuk aquocomplex, CA (oh2)N2+, di mana n biasanya dianggap enam; yaitu, "octahedron berair" di sekitar kalsium.
Sementara HCO anion3- Mereka berinteraksi dengan baik, baik dengan jembatan hidrogen (atau2Co-h-oh2) atau dengan atom hidrogen air ke arah beban negatif (Hoco2- H-OH, interaksi dipol).
Interaksi antara CA ini2+, HCO3- Dan air sangat efisien, sehingga membuat kalsium bikarbonat sangat larut dalam pelarut itu; Tidak seperti kalsium karbonat (caco3), di mana atraksi elektrostatik antara CA2+ dan rekannya32- Mereka sangat kuat, memicu larutan berair.
Selain air, ada co -molekul2 sekitar, yang bereaksi perlahan untuk berkontribusi lebih banyak HCO3- (Tergantung pada nilai pH).
Solid hipotetis
Sejauh ini, ukuran ion dan beban dalam kalsium bikarbonat, atau adanya air, jelaskan mengapa tidak ada senyawa padat; Artinya, kristal murni yang dapat ditandai dengan kristalografi x -ray. Kalsium bikarbonat tidak lebih dari ion yang ada di air dari mana formasi gua terus tumbuh.
Ya CA2+ dan HCO3- Mereka dapat mengisolasi diri dari air yang menghindari reaksi kimia berikut:
CA (HCO3)2(aq) → Caco3(s) + co2(g) + h2Atau (l)
Maka ini dapat dikelompokkan menjadi padatan kristal putih dengan proporsi stoikiometrik 2: 1 (2HCO3/1ca).
Dapat melayani Anda: 30 contoh suspensi kimiaTidak ada penelitian tentang strukturnya, tetapi bisa dibandingkan dengan natrium bikarbonat (seperti magnesium bikarbonat, MG (HCO3)2, juga tidak ada sebagai padatan), atau dengan kalsium karbonat.
Stabilitas: natrium bikarbonat (nahco3) Vs. kalsium bikarbonat (CA (HCO3)2)
Sodium bikarbonat mengkristal dalam sistem monoklinik, dan kalsium bikarbonat dalam sistem trigonal (kalsit) dan ortorombik (aragonit).
Jika NA diganti+ untuk ca2+, Jaringan kristal akan tidak stabil oleh perbedaan ukuran yang lebih besar; yaitu na+ Untuk menjadi lebih kecil, itu membentuk kaca yang lebih stabil dengan HCO3- dibandingkan dengan CA2+.
Faktanya, CA (HCO3)2(aq) membutuhkan air untuk menguap sehingga ion -ionnya dapat dikelompokkan ke dalam gelas; Tapi jaringan kristal ini tidak cukup kuat untuk melakukannya pada suhu kamar. Saat memanaskan air, reaksi dekomposisi terjadi (persamaan dari atas).
Menjadi ion na+ Dalam larutan, ini akan membentuk kaca dengan HCO3- Sebelum dekomposisi termal.
Alasannya mengapa kalsium bikarbonat tidak mengkristal (secara teoritis), adalah karena perbedaan radio ionik atau ukuran ion mereka, yang tidak dapat membentuk kristal yang stabil sebelum dekomposisi mereka.
Kalsium bikarbonat (CA (HCO3)2) Vs. kalsium karbonat (caco3)
Jika di sisi lain, H ditambahkan+ Ke struktur kristal kalsium karbonat, mereka akan secara drastis mengubah sifat fisiknya. Mungkin, titik peleburan mereka jatuh secara signifikan, dan bahkan morfologi kristal yang diubah dimodifikasi.
Sifat fisik dan kimia
Formula Kimia
CA (HCO3)2
Berat molekul
162.11 g/mol
Keadaan fisik
Itu tidak muncul dalam keadaan solid. Itu ditemukan dalam larutan air, dan ketika panas diterapkan untuk menguap, itu menjadi kalsium karbonat.
Kelarutan air
16.1 g/100 ml pada 0º C; 16,6 g/100 ml pada 20º C dan 18,4 g/100 ml pada 100º C.
Nilai -nilai ini merupakan indikasi afinitas besar molekul air oleh ion kalsium bikarbonat, seperti yang dijelaskan pada bagian sebelumnya. Sementara itu, hanya 15 mg kalsium karbonat larut dalam satu liter air, yang mencerminkan interaksi elektrostatik yang kuat.
Karena kalsium bikarbonat tidak dapat membentuk solid, kelarutannya tidak dapat ditentukan secara eksperimental.
Namun, mengingat kondisi yang dibuat oleh CO2 Terlarut dalam air yang mengelilingi batu kapur, massa kalsium yang dilarutkan pada suhu T dapat dihitung; massa yang akan sama dengan konsentrasi kalsium bikarbonat.
Dapat melayani Anda: asam benzyat: sintesis, transposisi dan penggunaanPada suhu yang berbeda, massa terlarut meningkat seperti yang ditunjukkan pada nilai pada 0, 20 dan 100º C. Kemudian, menurut percobaan ini, ditentukan berapa banyak kalsium bikarbonat Itu larut di sekitar kalsium karbonat, dalam medium berair dengan co2.
Setelah CO lolos2 Gas, kalsium karbonat akan mengendap, tetapi bukan kalsium bikarbonat.
Fusion dan titik didih
Jaringan kristal CA (HCO3)2 Itu jauh lebih lemah dari pada caco3. Jika dapat diperoleh dalam keadaan padat, dan mengukur suhu di mana ia meleleh di dalam sumber, tentunya nilai akan diperoleh jauh di bawah 899º C. Demikian juga, hal yang sama harus diharapkan dalam menentukan titik didih.
Titik pembakaran
Itu bukan bahan bakar.
Risiko
Karena senyawa ini tidak ada dengan solid, tidak mungkin merupakan risiko untuk memanipulasi solusi airnya, karena kedua ion CA2+ Seperti HCO3- Mereka tidak berbahaya bagi konsentrasi rendah; Dan oleh karena itu, risiko terbesar, yang akan menelan solusi seperti itu, hanya bisa disebabkan oleh dosis kalsium yang berbahaya yang dicerna.
Jika senyawa itu membentuk padatan, bahkan mungkin berbeda secara fisik dari caco3, Efek racunnya tidak bisa melampaui ketidaknyamanan dan reseksi sederhana setelah kontak fisik atau inhalasi.
Aplikasi
- Solusi kalsium bikarbonat telah digunakan sejak lama untuk mencuci kertas kuno, terutama karya seni atau dokumen penting yang secara historis.
- Solusi bikarbonat telah digunakan dalam pencegahan osteoporosis. Namun, dalam satu kasus, efek samping seperti hiperkalsemia, alkalosis metabolik dan gagal ginjal telah diamati dalam satu kasus.
- Kalsium bikarbonat diberikan, kadang -kadang, secara intravena untuk memperbaiki efek depresi hipokalemia pada fungsi jantung.
- Itu digunakan untuk menenangkan keasaman perut.
Referensi
- Wikipedia (2018). Kalsium bikarbonat. Diambil dari: di.Wikipedia.org
- Sirah Dubois (3 Oktober 2017). Apa itu kalsium bikarbonat? Pulih dari: livestrong.com
- Science Learning Hub (2018). Kimia Karbonat. Pulih dari: scientelarn.org.NZ
- Pubchem (2018). Kalsium bikarbonat. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah

