Sejarah Bromo, Struktur, Konfigurasi Elektronik, Properti, Penggunaan

- 1674
- 362
- Ray Thiel
Dia brom Ini adalah elemen non -metalik yang termasuk dalam kelompok halogens, kelompok 17 (viia) dari tabel periodik. Simbol kimianya adalah BR. Ini disajikan sebagai molekul diatomik, yang atomnya disatukan oleh ikatan kovalen, sehingga formula molekul ditetapkan2.
Tidak seperti fluoride dan klorin, bromin dalam kondisi terestrial bukanlah gas tetapi cairan coklat kemerahan (gambar bawah). Itu merokok, dan bersama dengan merkuri, satu -satunya elemen cair. Di bawahnya, yodium, meskipun warnanya meningkat dan menjadi ungu, dapat mengkristal dalam padatan yang mudah menguap.
 Botol dengan bromin cair murni. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Botol dengan bromin cair murni. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Bromo ditemukan, secara independen, pada tahun 1825 oleh Carl Löwig, yang belajar di bawah arahan ahli kimia Jerman Leopold Gmelin; Dan pada tahun 1826, oleh ahli kimia Prancis Antoine-Jerome Ballard. Namun, publikasi hasil eksperimen balard mendahului löwig.
Bromo adalah elemen ke -62 yang paling melimpah di Bumi, didistribusikan dalam konsentrasi rendah oleh korteks bumi. Di laut, konsentrasi rata -rata adalah 65 ppm. Tubuh manusia mengandung 0,0004 % bromin, tidak secara pasti mengetahui fungsinya.
Elemen ini dieksploitasi secara komersial di Salmuela atau tempat -tempat yang dengan kondisi khusus adalah garam tinggi; Misalnya, Laut Mati, tempat perairan wilayah tetangga, dipenuhi dengan garam berkumpul.
Ini adalah elemen korosif yang mampu menyerang logam, seperti platinum dan paladium. Dilarahkan dalam air, bromin juga dapat mengerahkan aksi korosifnya pada jaringan manusia, memperparah situasi karena asam bromyteric dapat dihasilkan. Mengenai toksisitasnya, itu dapat menyebabkan kerusakan penting pada organ, seperti hati, ginjal, paru -paru dan perut.
Bromin sangat berbahaya di atmosfer, menjadi 40-100 kali lebih destruktif untuk lapisan ozon daripada klorin. Setengah dari hilangnya lapisan ozon di Antartika diproduksi oleh reaksi yang terkait dengan bromometil, senyawa yang digunakan sebagai fumigant.
Ini memiliki banyak kegunaan, seperti: retarder api, zat pemutih, desinfektan permukaan, aditif bahan bakar, perantara dalam pembuatan obat penenang, dalam pembuatan bahan kimia organik, dll.
[TOC]
Sejarah
Carl Löwig bekerja
Bromo ditemukan secara mandiri dan hampir secara bersamaan oleh Carl Jacob Löwig, seorang ahli kimia Jerman pada tahun 1825, dan oleh Antoine Balard, seorang ahli kimia Prancis pada tahun 1826.
Carl Löwig, seorang murid ahli kimia Jerman Leopold Gmelin, mengumpulkan air dari pegas Kreuznach yang buruk dan menambahkan klorin; Setelah penambahan eter, ia mengaduk campuran cairan.
Kemudian, eter yang dipisahkan dengan distilasi dan memusatkannya dengan penguapan. Akibatnya, ia memperoleh zat coklat kemerahan, yang merupakan bromin.
Pekerjaan Balard Antoine
Balard, di sisi lain, menggunakan abu alga coklat. Dengan demikian bromo dilepaskan, klorin melewati bahan berair yang mengalami ekstraksi, di mana magnesium bromida, MGBR hadir2.
Selanjutnya, bahan disuling dengan adanya mangan dioksida dan asam sulfat, menghasilkan uap merah yang kental menjadi cairan gelap. Balard mengira itu adalah elemen baru dan memanggilnya muride, berasal dari kata Latin muria, yang dengannya air garam ditunjuk.
Itu dapat melayani Anda: materi hidup: konsep, karakteristik dan contohTelah ditunjukkan bahwa Balard mengubah nama Muride menjadi Brôme dengan saran Anglada atau Gay-Lussac, berdasarkan fakta bahwa Brôme berarti wab, yang mendefinisikan bau elemen yang ditemukan yang ditemukan.
Hasilnya diterbitkan oleh Belard di Annales of Chemie and Physique, sebelum Löwig menerbitkannya sendiri.
Hanya dari tahun 1858, bromin diproduksi dalam jumlah penting; tahun di mana deposit garam Stassfurt ditemukan dan dieksploitasi, mendapatkan bromin.
Struktur dan konfigurasi bromo elektronik
Molekul
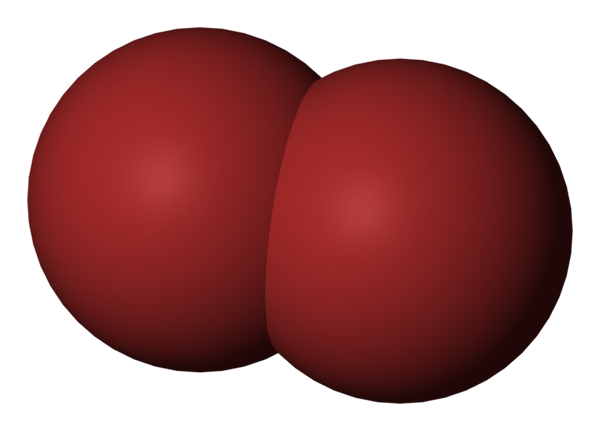 Molekul BR2. Sumber: Benjah-BMM27 [Domain Publik].
Molekul BR2. Sumber: Benjah-BMM27 [Domain Publik]. Pada gambar atas molekul brom ditampilkan, BR2, Dengan model pengisian yang ringkas. Sebenarnya, ada ikatan kovalen sederhana antara dua atom brom, BR-BR.
Menjadi molekul diatomik dan homogen, tidak memiliki momen dipol permanen dan hanya dapat berinteraksi dengan orang lain dari jenis yang sama melalui kekuatan dispersi London.
Inilah alasan mengapa cairan kemerahan Anda merokok; Dalam molekul BR2, Sementara mereka relatif berat, kekuatan antarmolekul mereka membuat mereka tetap lemah.
Bromo kurang elektronegatif daripada klorin, dan oleh karena itu, memberikan efek tarik yang lebih rendah pada elektron lapisan valencia. Akibatnya, dibutuhkan lebih sedikit energi untuk melakukan perjalanan tingkat energi yang lebih tinggi, menyerap foton hijau, dan mencerminkan warna kemerahan.
Kristal
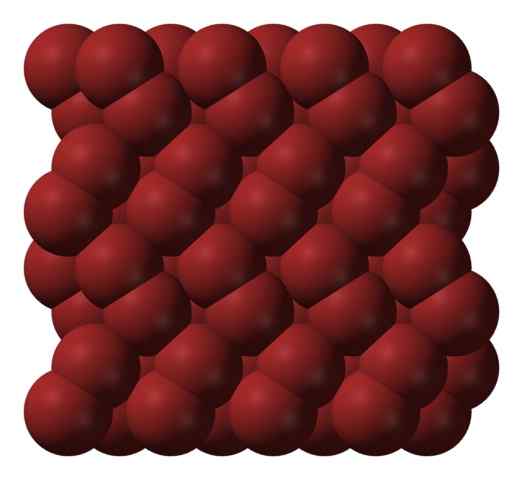 Struktur kristal bromo. Sumber: Ben Mills [domain publik].
Struktur kristal bromo. Sumber: Ben Mills [domain publik]. Dalam fase gas, molekul BR2 Mereka sangat berpisah sampai ada interaksi yang efisien di antara mereka. Namun, di bawah titik lelehnya, bromin dapat dibekukan dalam kristal orthorrombic kemerahan (gambar superior).
Perhatikan bagaimana molekul BR2 Mereka diposisikan secara tertib sedemikian rupa sehingga mereka tampak "cacing brom". Di sini dan pada suhu ini (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Keadaan lapisan dan oksidasi valencia
Konfigurasi brom elektronik adalah:
[Ar] 3d104s2 4p5
Menjadi 3d104s2 4p5 lapisan valensi (meskipun orbital 3D10 Tidak memiliki keunggulan dalam reaksi kimia Anda). Elektron orbital 4S dan 4P adalah yang terluar dan menambahkan total 7, hanya satu elektron untuk menyelesaikan oktet Valencia.
Dari konfigurasi ini, status oksidasi yang mungkin dapat disimpulkan untuk bromin: -1, jika suatu elektron mendapatkan isolektronik ke Kripton; +1, menjadi seperti 3D104s2 4p4; +3, +4 dan +5, kehilangan semua elektron dari orbital 4p ([ar] 3D104s24p0); dan +7, berjalan tanpa elektron di orbital 4s ([ar] 3d104s04p0).
Properti
Penampilan fisik
Cairan kemerahan coklat gelap kecil. Itu ditemukan di alam sebagai molekul diatomik, dengan atom yang disatukan oleh ikatan kovalen. Bromo adalah cairan yang lebih padat dari air dan tenggelam ke dalamnya.
Dapat melayani Anda: Radio: Struktur, Properti, Penggunaan, MemperolehBerat atom
79.904 g/mol.
Nomor atom
35.
Bau
Asap hektar, mencekik dan menjengkelkan.
Titik lebur
-7.2 ºC.
Titik didih
58.8 ºC.
Kepadatan (br2) cairan
3.1028 g/cm3
Kelarutan air
33,6 g/L A 25 ° C. Kelarutan brom dalam air rendah dan cenderung meningkat dengan mengurangi suhu; perilaku mirip dengan gas lainnya.
Kelarutan
Larut secara bebas dalam alkohol, eter, kloroform, karbon tetrachloride, karbon disulfida, dan asam klorida terkonsentrasi. Larut dalam pelarut non -polar dan beberapa kutub seperti alkohol, asam sulfat dan dalam banyak pelarut terhalogenasi.
Tiga poin
265,9 K pada 5,8 kPa.
Titik kritis
588 K pada 10,34 MPa.
Fusion Heat (BR2)
10.571 kJ/mol.
Panas penguapan (BR2)
29,96 kJ/mol.
Kapasitas kalori molar (BR2)
75,69 kJ/mol.
Tekanan uap
Pada suhu 270 K, 10 kPa.
Suhu diri sendiri
Tidak mudah terbakar.
titik pengapian
113 ºC.
Suhu penyimpanan
2 hingga 8 ºC.
Tegangan permukaan
40,9 mn/m A 25 ºC.
Ambang bau
0,05 - 3,5 ppm. 0,39 mg/m3
Indeks refraksi (ηd)
1.6083 hingga 20 ºC, dan 1.6478 hingga 25 ºC.
Elektronegativitas
2.96 pada skala Pauling.
Energi ionisasi
- Level Pertama: 1.139,9 kJ/mol.
- Level Kedua: 2.103 kJ/mol.
- Level ketiga: 3.470 kJ/mol.
Radio atom
120 PM.
Kovalen radio
120.3 sore.
Radio Van Der Waals
185 PM.
Reaktivitas
Ini kurang reaktif dari klorin, tetapi lebih reaktif daripada yodium. Ini adalah oksidan yang kurang kuat dari klorin dan lebih kuat dari yodium. Ini juga merupakan agen pereduksi yang lebih lemah dari yodium, tetapi lebih kuat dari klorin.
Klorin uap sangat korosif untuk banyak bahan dan jaringan manusia. Itu menyerang banyak elemen logam, termasuk platinum dan paladium; Tapi itu tidak menyerang timbal, nikel, magnesium, besi, seng, dan di bawah 300 ºC baik untuk natrium.
Bromo di dalam air mengalami perubahan dan berubah menjadi bromida. Itu juga bisa ada sebagai bromat (bro3-), Tergantung pada pH cair.
Karena aksinya pengoksidasi, bromin dapat menginduksi pelepasan radikal bebas oksigen. Ini adalah oksidan yang kuat dan dapat menyebabkan kerusakan jaringan. Juga, bromin dapat menghasilkan kunci kontak spontan saat dikombinasikan dengan kalium, fosfor atau timah.
Aplikasi
Aditif bensin
Ethylene dibromide digunakan untuk menghilangkan kemungkinan deposit timbal dalam mesin mobil. Setelah pembakaran bensin, yang menggunakan timbal sebagai aditif, bromin dikombinasikan dengan timbal untuk membentuk timbal bromida, gas volatil yang dikeluarkan oleh tabung buang.
Sementara bromin menghilangkan timah dari bensin, tindakan destruktif pada lapisan ozon sangat kuat, itulah sebabnya ia dibuang untuk aplikasi ini.
Pestisida
Metilen atau bromometil bromida digunakan sebagai pestisida untuk memurnikan tanah, terutama untuk menghilangkan nematoda parasit, seperti anylostome.
Namun, penggunaan sebagian besar senyawa yang mengandung bromin telah dibuang, sekali lagi, destruktif pada lapisan ozon.
Kontrol penerbitan Merkurius
Bromo digunakan pada beberapa tanaman untuk mengurangi emisi merkuri, logam yang sangat beracun.
Dapat melayani Anda: gravimetri: analisis gravimetri, metode, penggunaan dan contohFotografi
Perak bromida, selain yoduro perak dan perak klorida, digunakan sebagai senyawa sensitif cahaya dalam emulsi fotografi.
Tindakan Terapi
Kalium bromida, serta lithium bromida, digunakan sebagai obat penenang umum di abad ke -19 dan awal abad kedua puluh. Garam sederhana masih digunakan di beberapa negara seperti antikonvulsi.
Namun, FDA Amerika Serikat tidak menyetujui penggunaan bromin untuk pengobatan penyakit apa pun saat ini.
Retarder api
Bromin ditransformasikan oleh api menjadi asam bromhoric, yang mengganggu reaksi oksidasi yang terjadi selama api, dan menghasilkan kepunahannya. Polimer berisi bromin digunakan untuk membuat resin perlambatan kebakaran.
Aditif Makanan
Jejak kalium bromat ke tepung telah ditambahkan untuk meningkatkan memasaknya.
Reagen kimia dan perantara
Hidrogen bromida digunakan sebagai zat pereduksi dan katalis untuk reaksi organik. Bromo digunakan sebagai perantara kimia dalam pembuatan obat, cairan hidrolik, agen refrigeran, dehumidifier, dan dalam persiapan rambut bergelombang.
Ini juga menemukan penggunaan dalam elaborasi cairan pengeboran sumur, produk untuk desinfeksi air, agen keputihan, desinfektan permukaan, pewarna, aditif bahan bakar, dll.
Tindakan biologis
Sebuah studi yang dilakukan pada tahun 2014 menunjukkan bahwa bromin adalah kofaktor yang diperlukan untuk biosintesis kolagen IV, yang menjadikan bromin elemen penting untuk pengembangan jaringan hewan. Namun, tidak ada informasi tentang konsekuensi dari defisit elemen.
Di mana letaknya
Bromo diekstraksi secara komersial dari tambang garam dan sumur Salmuela yang dalam yang ditemukan di Negara Bagian Arkansas, dan di Danau Salty Great Salty Utah, keduanya di Amerika Serikat. Air garam terakhir ini memiliki konsentrasi brom 0,5 %.
Untuk mengekstrak bromin.
Laut Mati, di perbatasan antara Yordania dan Israel, adalah laut tertutup yang berada di bawah permukaan laut, yang menjadikannya konsentrasi garam yang sangat tinggi.
Bromo dan Potassa diperoleh secara komersial di sana, dengan penguapan air dengan garam tinggi dari Laut Mati. Di laut ini konsentrasi brom dapat mencapai 5 g/L.
Itu juga ditemukan dalam konsentrasi tinggi di beberapa mata air panas. Bominita, misalnya, adalah mineral bromida perak yang ditemukan di Bolivia dan Meksiko.
Risiko
Bromin dalam keadaan cair korosif untuk jaringan manusia. Tapi bahaya terbesar bagi manusia berasal dari uap brom dan inhalasi.
Bernapaslah di lingkungan dengan konsentrasi bromin 11-23 mg/m3 Itu menghasilkan kejutan parah. Konsentrasi 30-60 mg/m3 Itu sangat berbahaya. Sementara itu, konsentrasi 200 mg bisa berakibat fatal.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Pusat Nasional Informasi Bioteknologi. (2019). Brom. Database pubchem. CID = 23968. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Ross Rachel. (8 Februari 2017). Fakta tentang Bromine. Dipulihkan dari: LiveScience.com
- Wikipedia. (2019). Boraks. Diperoleh dari: di.Wikipedia.org
- Lentech b. V. (2019). Brom. Pulih dari: lentech.com
- « Karakteristik, struktur, jenis, dan fungsi myosin
- Karakteristik, Struktur, Jenis dan Fungsi Nucleas »

