Struktur Lithium Bromide, Properti, Penggunaan, Risiko
- 4055
- 558
- Irvin Reichel
Dia Lithium bromide Itu adalah garam netral dari logam alkali yang formula kimianya adalah libr. Rumus ini menyatakan bahwa padatan kristalnya terdiri dari ion li+ dan br- Dalam rasio 1: 1. Kristal Anda berwarna putih atau kristal ringan. Itu sangat larut dalam air dan juga, itu adalah garam yang agak higroskopis.
Properti terakhir ini memungkinkan penggunaannya sebagai pengeringan dalam sistem pendingin udara dan pendingin. Demikian juga, lithium bromida digunakan sejak awal abad ke -20 dalam pengobatan gangguan kesehatan mental tertentu, meninggalkan penggunaannya karena penggunaan garam yang tidak tepat.
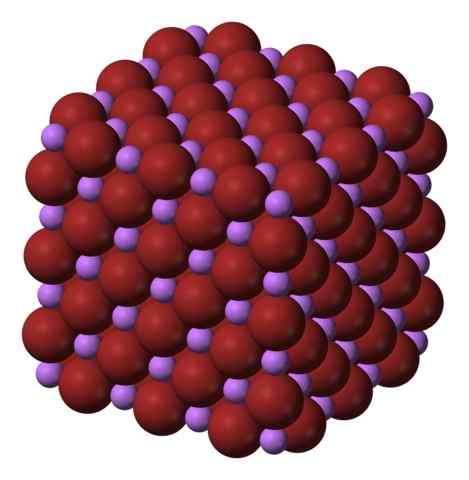
 Struktur kristal kubik perpustakaan. Sumber: Benjah-BMM27 via Wikipedia.
Struktur kristal kubik perpustakaan. Sumber: Benjah-BMM27 via Wikipedia. Perpustakaan diproduksi dengan pengobatan lithium karbonat, li2BERSAMA3, dengan asam bromhyteric. Setelah pemanasan medium, endapan dalam larutan berair sebagai hidrat.
Garam ini mengiritasi kulit dan mata karena kontak, sambil menghasilkan iritasi saluran pernapasan dengan inhalasi. Asupan garam lithium dapat menyebabkan mual, muntah, diare dan pusing.
[TOC]
Struktur lithium bromida
Formula perpustakaan memperjelas bahwa proporsi Li/BR sama dengan 1; Untuk setiap kation li+ Pasti ada br anion- dari mitra. Oleh karena itu, proporsi ini harus tetap konstan di setiap sudut kristal perpust.
Ion li+ dan br- Mereka saling menarik, mengurangi tolakan antara beban yang sama, untuk menyebabkan jenis permata kristal kubik; Ini isomorfik ke NaCl (gambar superior). Perhatikan bahwa seluruh set memiliki geometri kubik.
Dalam kristal ini, LI+ Mereka lebih kecil dan memiliki warna ungu muda; sedangkan BR- Mereka lebih tebal dan warna coklat yang intens. Diamati bahwa setiap ion memiliki enam tetangga, yang sama dengan mengatakan bahwa mereka menyajikan koordinasi oktahedral: Libr6 atau li6BR; Namun, jika sel kesatuan dipertimbangkan, proporsi Li/Br tetap 1.
Dapat melayani Anda: struktur kristalIni adalah struktur kristal yang diadopsi lebih disukai oleh perpustakaan. Namun, itu juga dapat membentuk jenis kristal lain: wurzita, jika mengkristal pada suhu rendah (-50 ° C) pada substrat; o kubik yang berpusat pada tubuh, atau tipe CSCL, jika garam kaca kubik mengalami tekanan tinggi.
Melembabkan dan kaca
Hal di atas berlaku untuk pustaka anhidrat. Garam ini bersifat higroskopis, dan karenanya dapat menyerap kelembaban lingkungan, mengarahkan molekul air ke dalam kristal mereka sendiri. Dengan demikian, pustaka · nh hidrat muncul2Atau (n = 1, 2, 3 ..., 10). Untuk setiap hidrat, struktur kristal berbeda.
Misalnya, studi kristalografi menentukan bahwa perpustakaan · h2Atau mengadopsi struktur jenis perovskita.
Ketika hidrat ini dalam larutan berair, mereka dapat meluap dan meluap sendiri; Yaitu, mereka mengadopsi struktur kristal, tetapi secara molekuler tidak teratur. Dalam kondisi seperti itu, jembatan hidrogen air menjadi sangat penting.
Properti
Berat molekul
88.845 g/mol.
Penampilan
Solid kristal putih atau krem ringan.
Bau
WC.
Titik lebur
552 ºC (1.026 ºF, 825 K).
Titik didih
1.256 ºC (2.309 ºF, 1.538 K).
Kelarutan air
166,7 g/100 ml pada 20 ° C. Perhatikan kelarutan tinggi Anda.
Kelarutan dalam pelarut organik
Larut dalam metanol, etanol, eter dan aseton. Sedikit larut dalam piridin, senyawa aromatik dan kurang kutub dari yang sebelumnya.
Indeks refraksi (ηd)
1.784.
Kapasitas kalori
51.88 j/mol · k.
Entropi molar standar (sθ 298)
66.9 J/mol · k.
titik pengapian
1.265 ºC. Dianggap tidak mudah terbakar.
Stabilitas
Stabil. Bentuk anhidra, bagaimanapun, sangat higroskopis.
Penguraian
Saat terurai dengan pemanasan, itu menyebabkan lithium oksida.
Dapat melayani Anda: asam klorogenikph
Antara pH 6 dan 7 dalam larutan berair (100 g/L, 20 ºC).
Reaktivitas
Lithium bromide tidak reaktif dalam kondisi lingkungan normal. Namun, Anda dapat mengalami reaksi yang kuat dengan asam kuat saat suhu meningkat.
Saat larut dalam air, ada peningkatan suhu, yang disebabkan oleh entalpi hidrasi negatif.
Produksi
Perpustakaan terjadi dengan bereaksi lithium hidroksida atau lithium karbonat dengan asam bromyteric dalam reaksi netralisasi:
Li2BERSAMA3 + Hbr => lib +co2 + H2SALAH SATU
Lithium bromide diperoleh sebagai hidrat. Untuk mendapatkan bentuk anhidrat, perlu memanaskan garam terhidrasi di bawah vakum.
Tata nama
Nama 'lithium bromide' berasal dari menjadi halogenida logam, dinamai menurut nomenklatur stok. Nama -nama lain, sama -sama valid tetapi kurang digunakan, adalah lithium monobromure, sesuai dengan nomenklatur sistematis; dan litik bromida (valensi unik +1 untuk lithium), menurut nomenklatur tradisional.
Aplikasi
Desiccant
Perpustakaan adalah garam higroskopis, membentuk air garam pekat yang mampu menyerap kelembaban udara dalam berbagai suhu. Air garam ini digunakan sebagai pengeringan dalam sistem pendingin udara dan pendingin.
Serat
Ini digunakan untuk meningkatkan volume wol, rambut, dan serat organik lainnya.
Adducts Farmasi
Perpustakaan membentuk adducts dengan beberapa senyawa farmasi, memodulasi aksinya. Aduk adalah kombinasi dengan mengoordinasikan dua atau lebih molekul, tanpa perubahan struktural dari salah satu molekul persatuan.
Obat penenang
Lithium bromide digunakan pada awalnya sebagai obat penenang pada gangguan mental tertentu, berhenti digunakan pada tahun 1940. Saat ini, lithium karbonat digunakan; Namun dalam kasus apa pun, lithium adalah elemen yang memberikan aksi terapeutik di kedua senyawa.
Itu dapat melayani Anda: plumbose oxide (pbo): rumus, sifat, risiko dan penggunaanLithium digunakan dalam pengobatan gangguan bipolar, telah berguna dalam kontrol episode manik dari gangguan tersebut. Lithium dianggap menghambat aktivitas neurotransmiter rangsang, seperti dopamin dan asam glutamat.
Di sisi lain, aktivitas sistem penghambatan yang dimediasi oleh neurotransmitter gamma-amino-butyric acid (GABA) meningkat (GABA). Tindakan ini bisa menjadi bagian dari dasar tindakan terapeutik lithium.
Risiko
Hubungi toksisitas
Iritasi kulit dan kepekaan, alergi. Cedera mata yang serius atau iritasi mata, pada saluran pernapasan, lubang hidung dan tenggorokan.
Proses menelan
Gejala utama karena asupan lithium bromida adalah: gangguan gastrointestinal, muntah dan mual. Efek samping lainnya pada konsumsi garam termasuk agitasi, kejang dan kehilangan kesadaran.
Kondisi yang dikenal sebagai "bromisme" dapat terjadi dengan dosis lithium -bromide lebih besar dari 225 mg/hari.
Dalam bromisme beberapa gejala dan tanda -tanda berikut dapat terjadi: eksaserbasi jerawat dan kehilangan nafsu makan, tremor, masalah bicara, apatis, kelemahan dan agitasi maniak.
Referensi
- Formulasi Kimia. (2019). Lithium bromide. Pulih dari: formulasi quimica.com
- David c. Johnson. (10 Juli 2008). Pesanan baru untuk lithium bromide. Alam. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (S.F.). Transisi fase struktural dalam lithium bromida: efek tekanan dan suhu. [PDF]. Pulih dari: ncpcm.di dalam
- Takamuku et al. (1997). Studi difffraksi X-ray pada larutan lithium bromida dan lithium iodida supercooled. Departemen Kimia, Fakultas Sains, Universitas Fukuoka, Nanakuma, Jonan-ku, Fukuoka 814-80, Jepang.
- Pusat Nasional Informasi Bioteknologi. (2019). Lithium bromide. Database PubChem, CID = 82050. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2019). Lithium bromide. Diperoleh dari: di.Wikipedia.org
- Royal Society of Chemistry. (2019). Lithium bromide. Chemspider. Pulih dari: chemspider.com
- « Sifat alkil halogenuros, mendapatkan, contoh
- Meksiko dalam tindakan abad ke -18 dan perubahan sosial ekonomi »

