Sifat alkil halogenuros, mendapatkan, contoh
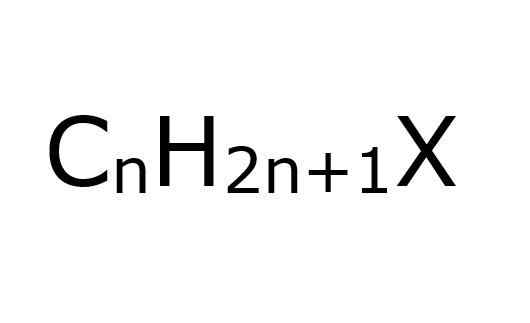
- 2247
- 457
- Irvin Reichel
Itu alkil halogenuros Mereka adalah senyawa organik di mana atom karbon dengan hibridisasi SP3 halogen terkait secara kovalen (f, cl, br, i). Dari perspektif lain, lebih mudah, untuk menyederhanakan, menganggap bahwa mereka adalah haloalcanos; Ini, bagi mereka yang telah diganti beberapa atom halogen H.
Juga, seperti namanya, atom halogen harus dikaitkan dengan kelompok alquilis, r, untuk dipertimbangkan dari jenis halogenida ini; Meskipun, secara struktural mereka dapat diganti atau bercabang dan memiliki cincin aromatik, dan masih terus menjadi alkil halogenide.
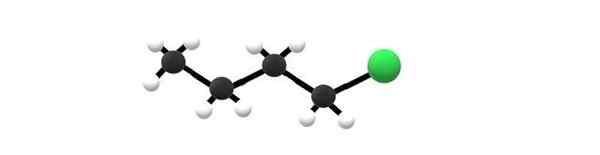 Molekul 1-klorobutano, contoh alkil halogenida. Sumber: Gabriel Bolívar.
Molekul 1-klorobutano, contoh alkil halogenida. Sumber: Gabriel Bolívar. Di atas Anda memiliki molekul 1-klorobutano, yang sesuai dengan salah satu halogenida alkil paling sederhana. Dapat dilihat bahwa semua karbon mereka memiliki ikatan sederhana, dan juga memiliki hibridisasi SP3. Oleh karena itu, bola hijau, sesuai dengan atom CL, terkait dengan kerangka yang berasal dari alkana butana.
Contoh bahkan lebih sederhana dari 1-chlorobutano adalah yang berasal dari gas metana: hidrokarbon terkecil dari semuanya.
Dari molekul cho -nya4 Anda dapat mengganti atom H dengan, untuk mengatakan, yodium. Jika A H diganti, CH akan3I (yodomethane atau methyl iodide). Saat dua jam diganti, CH akan2yo2 (Diyodomethane atau methylene iodide). Diikuti dan akhirnya, saya mengganti semua H memberikan chi3 (iodoform), dan CI4 (Karbon Tetrayoduro).
Sewa halogenuros ditandai dengan menjadi sangat reaktif dan, memiliki atom -atom paling elektronegatif dari tabel periodik, diintuisi bahwa melalui mekanisme simfin melakukan pengaruh pada matriks biologis.
[TOC]
Sifat alkil halogenuros
Sifat keluarga senyawa ini bergantung pada struktur molekulnya. Namun, jika dibandingkan dengan alkana mereka, perbedaan penting yang disebabkan oleh fakta sederhana ada tautan C-X (x = atom halogen).
Artinya, tautan C-X bertanggung jawab atas perbedaan atau kesamaan antara satu atau lebih alkil halogenuros.
Untuk mulai dengan, tautan C-H hampir apolar, mengingat perbedaan elektronegativitas yang rendah antara C dan H; Sebaliknya, tautan C-X memiliki momen dipol permanen, karena halogen lebih elektronegatif daripada karbon (terutama fluor).
Di sisi lain, beberapa halogen ringan (F dan CL), sementara yang lain berat (BR dan I). Massa atomnya juga membentuk perbedaan dalam tautan C-X; Dan pada gilirannya, langsung di sifat halogenide.
Oleh karena itu, menambahkan halogen ke hidrokarbon sama dengan meningkatkan polaritas dan massa molekulnya; Itu sama untuk membuatnya kurang mudah menguap (sampai batas tertentu), kurang mudah terbakar, dan meningkatkan titik mendidih atau fusi.
Titik mendidih dan fusi
Di atas ditunjukkan, dalam urutan meningkat, ukuran dan oleh karena itu berat halogen yang berbeda:
F < Cl < Br < I
Kemudian, diharapkan bahwa alkil halogenida yang mengandung atom F lebih ringan daripada mereka yang memiliki atom BR atau i.
Misalnya, beberapa halogenuros yang berasal dari metana dipertimbangkan:
Ch3F < CH3Cl < CH3Br < CH3yo
Ch2F2 < CH2Cl2 < CH2Br2 < CH2yo2
Dan seterusnya untuk produk turunan lainnya dari tingkat halogenasi yang lebih tinggi. Perhatikan bahwa pesanan dipertahankan: fluorine halogenuros lebih ringan dari yodium. Tidak hanya itu, tetapi juga titik -titik mendidih dan fusi juga mematuhi perintah ini; Rebus RF pada suhu yang lebih rendah daripada RI (r = cho3, Untuk kasus ini).
Dapat melayani Anda: substitusi elektrofilik aromatik: mekanisme dan contohDemikian juga, semua cairan itu tidak berwarna, karena dalam ikatan C-X mereka, elektron tidak dapat menyerap atau melepaskan foton untuk melakukan perjalanan tingkat energi lainnya. Namun, karena mereka menjadi lebih berat mereka dapat mengkristal dan menunjukkan warna (seperti yang dilakukan iodoform, chi3).
Polaritas
Tautan C-X berbeda dari polaritas, tetapi dalam urutan terbalik di atas:
C-f> c-cl> c-br> c-i
Oleh karena itu, tautan C-F lebih polar daripada tautan C-I. Menjadi lebih kutub, halogenuros RF cenderung berinteraksi melalui kekuatan dipol-dipolo. Sementara itu, di RBR atau RI halogenuros, momen dipol mereka lebih lemah dan interaksi yang diatur oleh kekuatan dispersi London mendapatkan kekuatan yang lebih besar.
Kekuatan pelarut
Karena alkil halogenida lebih polar daripada alkana dari mana mereka berasal, mereka meningkatkan kemampuan mereka untuk melarutkan jumlah senyawa organik yang lebih besar. Karena alasan inilah mereka cenderung menjadi pelarut yang lebih baik; Meskipun, itu tidak berarti bahwa mereka dapat menggantikan alkana di semua aplikasi.
Ada kriteria teknis, ekonomi, ekologis, dan kinerja untuk lebih memilih pelarut terhalogenasi daripada alkana.
Tata nama
Ada dua cara untuk menamai alkil halogenide: dengan nama umum, atau dengan nama sistematisnya (IUPAC). Nama umum biasanya lebih nyaman digunakan saat RX sederhana:
Chcl3
Kloroform: Nama Umum
Metil atau trichloromethane trichloride: nama iupac.
Tetapi nama sistematis lebih disukai (dan satu -satunya pilihan), ketika mereka memiliki struktur bercabang. Ironisnya, nama umum bermanfaat lagi ketika struktur terlalu rumit (seperti yang akan terlihat di bagian terakhir).
Aturan untuk memberi nama senyawa sesuai dengan sistem IUPAC sama dengan alkohol: rantai utama diidentifikasi, yang merupakan yang terpanjang atau paling bercabang. Kemudian, karbon terdaftar mulai dari akhir yang paling dekat dengan substituen atau konsekuensi, penamaan urutan alfabet.
Contoh
Untuk mengilustrasikannya, Anda memiliki contoh berikut:
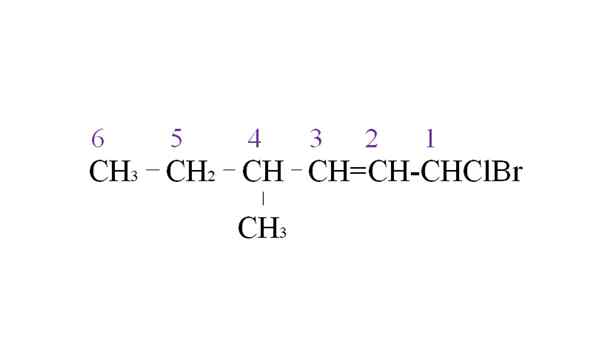 Sewa halogenide sebagai contoh nomenklatur. Sumber: Gabriel Bolívar.
Sewa halogenide sebagai contoh nomenklatur. Sumber: Gabriel Bolívar. Cabang pertama adalah gugus metil dalam C-4; Tapi, memiliki ikatan rangkap prioritas sebelumnya atas aturan yang diucapkan. Untuk alasan itu, rantai terpanjang mulai terdaftar dari kanan, dipimpin oleh atom karbon yang terkait dengan dua halogen: CL dan BR.
Dengan enumerasi, substituen dinamai dalam urutan abjad:
1-bromo-1-clor-4-methyl-2-hexen.
Memperoleh
Untuk mendapatkan alkil halogenida, molekul harus diserahkan ke proses halogenasi; yaitu, untuk memasukkan atom halogen ke dalam strukturnya, terutama ke atom ke spr a karbon3.
Ada dua metode untuk mendapatkan atau mensintesisnya: dengan radiasi ultraviolet melalui mekanisme radikal bebas, atau dengan menambahkan hydracest atau halogen.
Halogenasi dengan radiasi cahaya atau ultraviolet
Yang pertama, yang paling tidak tepat dan dengan hasil terburuk, terdiri dari alkana iradiasi dengan radiasi ultraviolet (Hv) Di hadapan halogen. Misalnya, persamaan untuk klorinasi metana ditampilkan:
Ch4 + Cl2 => Ch3Cl + HCl (di bawah sinar ultraviolet)
Ch3Cl + Cl2 => Ch2Cl2 + Hcl
Ch2Cl2 + Cl2 => Chcl3 + Hcl
Chcl3 + Cl2 => Ccl4 + Hcl
Keempat senyawa (ch3Cl, ch2Cl2, Chcl3 dan ccl4) Mereka terbentuk, dan karena itu ada campuran, yang dapat mengalami distilasi fraksional. Namun, metode ini tidak terlalu praktis, dan lebih disukai untuk menggunakan sintesis organik.
Dapat melayani Anda: asam fenilasetat: struktur, sifat, penggunaan, efekContoh lain adalah bromasi N-heksana:
Ch3Ch2Ch2Ch2Ch2Ch3 + Br2 => Ch3(Br) chch2Ch2Ch2Ch3 + HBR
Sekali lagi, dalam reaksi ini radiasi cahaya atau ultraviolet digunakan untuk mendukung pembentukan radikal bebas. Bromin, seperti cairan merah yang intens, berubah warna saat bereaksi, sehingga mengamati perubahan warna merah hingga berwarna ketika 2-bromohexan.
Penambahan hydracests atau halogen ke alkena
Metode kedua untuk mendapatkan alkil halogenuros adalah mengobati alkohol (ROH) atau alkena (r2C = Cr2) Dengan hidrace. Hidrasida memiliki formula umum HX (HF, HCL, HBR dan HI). Contoh akan ditampilkan menggunakan etanol untuk masing -masing:
Ch3Ch2Oh + hf => ch3Ch2F + h2SALAH SATU
Ch3Ch2Oh + hcl => ch3Ch2Cl + H2SALAH SATU
Ch3Ch2Oh + hbr => ch3Ch2BR + H2SALAH SATU
Ch3Ch2Oh + hai => cho3Ch2I + h2SALAH SATU
Juga, alkena dapat menambahkan molekul HX ke ikatan rangkap mereka, membentuk alkil halogenuros sekunder.
Ch2= CH-CH3 + HBR => BRCH2-Ch2-Ch3 + Ch3-CHBR-CH3
Produk BRCH2-Ch2-Ch3 Itu adalah 1-bromopropano, dan cho3-CHBR-CH3 2-bromopropan. Yang kedua adalah produk mayoritas karena itu adalah yang memiliki stabilitas terbesar, sedangkan yang pertama diproduksi pada tingkat yang lebih rendah karena lebih tidak stabil. Ini karena cho3Chbrch3 Ini adalah alkil halogenida sekunder.
Sangat mirip terjadi ketika apa yang ditambahkan ke alkena adalah molekul x2:
Ch2= CH-CH3 + Br2 => BRCH2-CHBR-CH3
Namun, alkil halogenida dengan dua atom brom yang terkait dengan karbon yang berdekatan diperoleh; lingkungan alkil halogenide. Jika, di sisi lain, dua bomos yang terkait dengan karbon yang sama diambil, akan ada alkil halogenida geminal, seperti berikut:
Br2Ch-ch2-Ch3
Reaksi
Substitusi Nukleofilik
Reaktivitas alkil halogenida berada dalam kerapuhan atau resistensi dari tautan C-X. Semakin berat halogen, semakin lemah ikatannya, dan karenanya, akan lebih mudah pecah. Dalam reaksi kimia, tautan rusak dan yang baru terbentuk; Tautan C-X rusak, untuk membentuk tautan C-G (G = grup baru).
Dalam istilah yang lebih tepat, X bertindak sebagai kelompok keluar, dan G sebagai kelompok yang masuk dalam reaksi Substitusi Nukleofilik. Mengapa reaksi ini terjadi? Karena x, menjadi lebih elektronegatif daripada karbon, "mencuri" kepadatan elektronik meninggalkan defisit elektron yang diterjemahkan sebagai beban parsial positif:
Cδ+-Xδ-
Jika spesies negatif ada di sekitarnya (: g-) atau netral dengan sepasang elektron yang tersedia (: g), mampu membentuk tautan C-G yang lebih stabil, x akhirnya akan digantikan oleh g. Di atas dapat diwakili dengan persamaan kimia berikut:
Rx +: g- => Rg + x-
Semakin lemah tautan C-X atau R-X, semakin besar reaktivitas atau kecenderungan untuk digantikan oleh Agen nukleofilik (atau nukleofil) g; yaitu, pecinta inti atau tuduhan positif.
Contoh
Serangkaian persamaan umum untuk substitusi nukleofilik yang mungkin menderita alkil halogenida ditunjukkan di bawah ini:
Rx + oh- => RoH + x- (Alkohol)
+ Atau'- => Ror' (Ethers, Sintesis Williamson)
+ yo- => Ri (alkyl yoduros)
+ Cn- => Rcn (nitrilos)
+ R'Coo- => Rcoor '(ester)
+ NH3 => Rnh2 (Amina)
+ P (c6H5)3 => Rp (c6H5)3+ X- (Garam fosfonium)
+ SH- => Rsh (tioles)
Dapat melayani Anda: tahapan kimiaDari contoh -contoh ini, alkil halogenida yang berharga untuk sintesis organik dapat dicurigai. Salah satu dari banyak pengganti yang hilang adalah reaksi Friedel Crafts, yang digunakan untuk "menyewa" cincin aromatik:
Rx + arh + alcl3 => Rra
Dalam reaksi ini, cincin aromatik digantikan oleh grup R -dari RX.
Eliminasi
Sewa halogenida dapat melepaskan molekul HX melalui reaksi eliminasi; Secara khusus, dehidrohalogenasi:
R2CH-CXR2 + Oh- => R2C = Cr2 + Hx
Dikatakan bahwa dehidrohalogenasi terjadi karena baik H dan X hilang dalam molekul HX yang sama.
Sintesis Reagen Grignard
Sewa halogenida dapat bereaksi dengan logam tertentu yang membentuk reagen Grignard, digunakan untuk menambahkan kelompok R ke molekul lain. Persamaan umum sintesisnya adalah sebagai berikut:
Rx + mg => rmgx
Contoh
Di seluruh bagian, beberapa contoh alkil halogenuros telah disebutkan. Beberapa lainnya, sederhana, adalah:
-Etil klorida, ch3Ch2Cl
-Isopropil fluoruro, (ch3)2Ch2F
-2-metil-3-chloropentano, ch3-Ch (ch3) -Chcl -ch2Ch3
-Secbutilo Yoduro, ch3Ch2Ch2I-ch3
-3-bromo-6-iodheptano, ch3-Ch2-CHBR-CH2-Ch2-Ch2yo
-3.4-dibromo-1-penteno, ch3-Chbr-chbr-ch = ch2
Aplikasi
Pelarut
Pada bagian sebelumnya, menyebutkan kapasitas pelarut alkil halogenida dibuat. Dari properti ini industri telah memanfaatkannya sebagai pembersih, baik untuk materi tekstil, komponen elektronik, atau menghapus bintik -bintik pernis.
Mereka juga digunakan sebagai pelarut lukisan, atau sampel organik atau berlemak untuk jenis tes analitik yang tak terhitung banyaknya.
Sintesis organik
Sewa halogenuros sangat berguna untuk "menyewa" cincin aromatik, sambil berfungsi sebagai sumber awal untuk sintesis praktis semua keluarga senyawa organik lainnya. Secara sintetis, RX dianggap sebagai sumber kelompok atau rantai R, yang dapat diinginkan untuk menggabungkan senyawa yang sangat aromatik.
Industri farmasi
Disebutkan pada awalnya bahwa atom halogen berinteraksi dengan matriks biologis, jadi dalam organisme kita mereka tidak bisa tidak diperhatikan tanpa menghasilkan perubahan, positif atau negatif. Jika obat memberikan efek positif pada tubuh, memiliki atom halogen yang efeknya mungkin meningkat atau tidak.
Jadi, jika X secara langsung menghubungkan karbon dengan hibridisasi SP3, Akan ada alkil halogenida dan bukan turunan yang terhalogenasi. Beberapa halogenuros seperti itu ditunjukkan di bawah ini dalam seri gambar berikut:
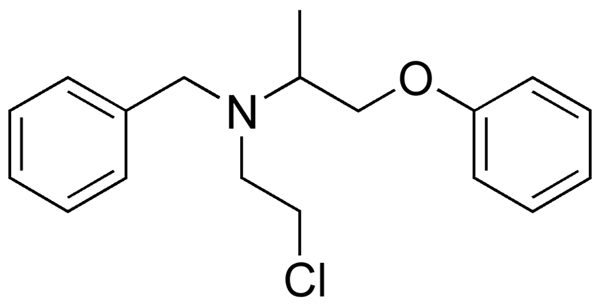 Fenoksibenzamine, obat yang digunakan untuk menggabungkan tekanan darah pada pasien dengan pheochromocytoma. Sumber: Utennt: Mark Pea [domain publik].
Fenoksibenzamine, obat yang digunakan untuk menggabungkan tekanan darah pada pasien dengan pheochromocytoma. Sumber: Utennt: Mark Pea [domain publik].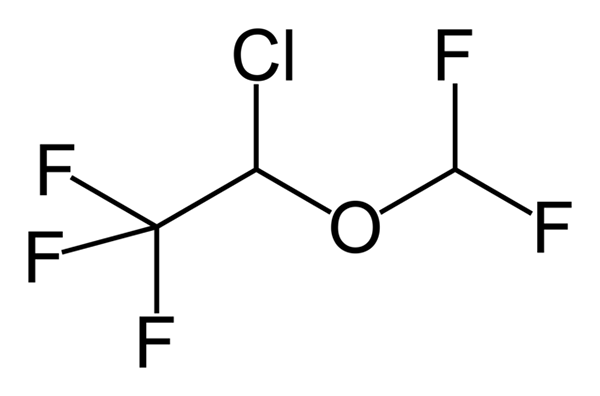 Isoflurano, anestesi inhalasi. Sumber: Benjah-BMM27 [Domain Publik].
Isoflurano, anestesi inhalasi. Sumber: Benjah-BMM27 [Domain Publik].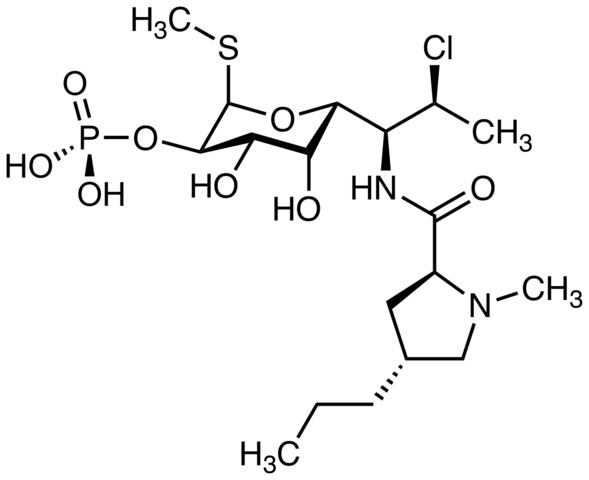 Clindamycin, antibiotik. Sumber: M Mitcheltrate [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)].
Clindamycin, antibiotik. Sumber: M Mitcheltrate [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)].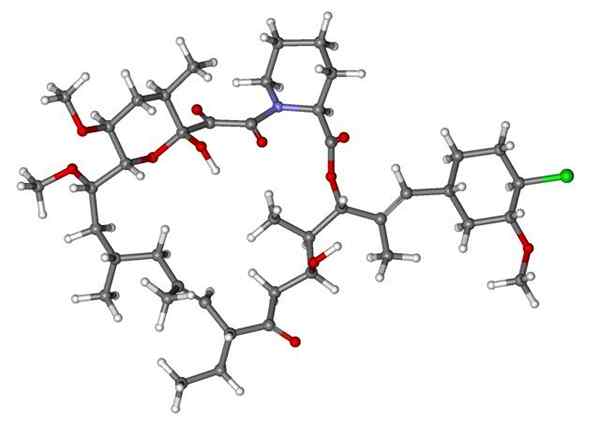 Pimecrolimus, digunakan untuk mengobati dermatitis atopik. Dapatkah Anda menemukan atom klorin? Sumber: Marinavladivok [CC0].
Pimecrolimus, digunakan untuk mengobati dermatitis atopik. Dapatkah Anda menemukan atom klorin? Sumber: Marinavladivok [CC0]. Halomon, agen antitumoral yang mungkin dan alkil halogenida dari alga rumput laut Portieria hornemannii, sumber alami. Sumber: Jü [domain publik]
Halomon, agen antitumoral yang mungkin dan alkil halogenida dari alga rumput laut Portieria hornemannii, sumber alami. Sumber: Jü [domain publik]
Perhatikan bahwa dalam lima obat ini ada setidaknya satu tautan dari jenis CHO2-X atau ch-x; Artinya, halogen terkait dengan sp -carbon3.
Refrigeran
Refrigeran Freón-12 yang terkenal (CHCIF2), Seperti fluoroalcanos atau hidrofluorokarbon lainnya, mereka menggantikan amonia dan klorofluorokarbon (CFC) dalam fungsi ini karena, bahkan menjadi zat yang tidak volatil atau beracun, mereka menghancurkan lapisan ozon; Sementara freón-12, karena lebih reaktif, dihancurkan sebelum mencapai ketinggian seperti itu.
Referensi
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Clark Jim. (14 Juli 2016). Penggunaan Alkyl Halids. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Gál, b., Bucher, c., & Burns, n. Z. (2016). Chiral Alkyl Halides: Motif Motif yang Diperjelas dalam Kedokteran. Obat Laut, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkyl Halides. Diperoleh dari: chemed.Chem.Purdue.Edu
- Patkar Prachi. (16 Juli 2017). All About Alkyl Halides: Properti, Penggunaan, dan banyak lagi. Struct Sains. Pulih dari: sciencestruck.com
- R. mengirimkan. (2016). Alkyl Halides. Pulih dari: hyperphysics.Phy-astr.GSU.Edu
- Panduan Pembelajaran untuk Bab 9 - Alkyl Halides i. Pulih dari: kaktus.Dixie.Edu
- Q.KE. Eduardo Vega Barrios. (S.F.). Sewa Halogenuros: Properti, Penggunaan dan Aplikasi. [PDF. Pulih dari: cvonline.Uaeh.Edu.MX
- « Struktur asam nitro (HNO2), sifat, sintesis
- Struktur Lithium Bromide, Properti, Penggunaan, Risiko »

