Kadmium (CD) Sejarah, sifat, struktur, penggunaan

- 1731
- 50
- Joseph Nader PhD
Dia kadmium (CD) adalah logam transisi atau post -transisi dari nomor atom 48 dan warna perak. Ini lunak dan ulet, dengan titik leleh dan mendidih yang relatif rendah. Kadmium adalah elemen langka dan hampir tidak memiliki konsentrasi 0,2 g / ton kerak bumi.
La Greenockita (CDS) adalah satu -satunya MENA penting dari kadmium yang menghadirkan warna kuning yang intens. Kadmium dikaitkan dengan seng dalam sphalerite (Zns), yang mengandung antara 0,1 dan 03 % kadmium sebagai kation CD2+.
 Kristal Kadmium. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)]
Kristal Kadmium. Sumber: Gambar Hi-Res Elemen ofchemical [CC oleh 3.0 (https: // createveCommons.Org/lisensi/oleh/3.0)] Saat memproses sphannel untuk mendapatkan, pengecoran dan pemurnian seng, kadmium diperoleh secara sekunder, ini menjadi sumber produksi utamanya.
Logam ini ditemukan pada tahun 1817, secara independen oleh Friedrich Stromayer dan Karl Hermann. Stromayer membaptis elemen baru dengan nama kadmium, berasal dari kata Latin "cadmia", sebuah istilah sebagai calamine (seng karbonat) diketahui (seng karbonat).
 Kadmium adalah elemen kimia dengan simbol CD dan nomor atomnya adalah 48. Sumber: Albedo-Ukr CC BY-SA 2.5 (http: // createveCommons.Org/lisensi/by-sa/2.5/)
Kadmium adalah elemen kimia dengan simbol CD dan nomor atomnya adalah 48. Sumber: Albedo-Ukr CC BY-SA 2.5 (http: // createveCommons.Org/lisensi/by-sa/2.5/) Kadmium adalah elemen dari utilitas yang hebat dan banyak aplikasi, seperti besi antikorosif, baja dan logam non -jimat; Gunakan sebagai pigmen; Stabilisasi PVC; elemen dalam paduan yang digunakan dalam lasan; Baterai nikel-kadmium yang dapat diisi ulang, dll.
Namun, ini adalah elemen yang sangat beracun yang menyebabkan kerusakan parah pada paru -paru, ginjal dan tulang, dan bahkan aksi karsinogenik telah diindikasikan, itulah sebabnya penggunaannya terbatas. Namun terlepas dari ini, itu terus digunakan dengan cermat dalam beberapa aplikasi.
[TOC]
Sejarah
- Penemuan ganda
Kadmium ditemukan oleh Friedrich Stromayer, seorang ahli kimia Jerman, pada tahun 1817 dalam sampel karbonat seng (calamina). Pada tahun yang sama, k. S. L. Hermann dan J. C. H. Roloff membuat penemuan yang sama, secara independen, dalam percobaan yang dilakukan dengan seng sulfida.
Telah ditunjukkan bahwa Stromayer membuat penemuannya selama pemenuhan aplikasi pemerintah untuk memeriksa apotek kota Hildesheim, Jerman. Seng oksida, seperti sekarang, digunakan dalam pengobatan kondisi kulit tertentu.
Tampaknya apotek tidak mengeluarkan seng oksida, tetapi sebaliknya menjual seng karbonat: bahan baku untuk produksi seng oksida. Produsen seng oksida berpendapat bahwa seng karbonat dipanaskan "seng oksida" kuning.
Kadmium oksida
Mereka tidak bisa menjual "seng oksida" ini, karena warna senyawa biasanya putih; Dan sebaliknya, mereka menjual seng karbonat, juga putih. Mengingat situasi ini, Stromayer memutuskan untuk mempelajari dugaan zinc oksida kuning.
Untuk melakukan ini, ia menghangatkan sampel seng karbonat (calamine) dan ada seng oksida kuning, seperti yang diinformasikan. Setelah menganalisisnya, ia menyimpulkan bahwa warna kuning adalah produk karena adanya oksida logam dari elemen baru.
Setelah mengekstraksi oksida logam baru ini, ia menghasilkan pengurangan, mencapai isolasi kadmium. Stromayer menentukan kepadatannya dan memperoleh nilai 8,75 g/cm3, Dekat dengan nilai yang diketahui saat ini untuk parameter ini (8,65 g/cm3).
Demikian juga, Stromayer menunjukkan bahwa elemen baru memiliki penampilan yang mirip dengan platinum, dan itu juga ada dalam banyak senyawa seng, dan termasuk dalam seng yang dimurnikan.
Stromayer menyarankan nama "kadmium" dari suara Latin "cadmia", nama yang disebut calamina, znco3.
Kadmium dalam seng sulfida
Karl Hermann (1817) menemukan warna kuning yang tidak ternoda ketika dia memproses seng sulfida dan berpikir itu bisa menjadi kontaminasi dengan arsenik. Tetapi begitu kemungkinan ini dibuang, Hermann menyadari bahwa ia berada di hadapan elemen baru.
- Aplikasi
1840-1940
Pada tahun 1840 -an penggunaan kadmium mulai dieksploitasi sebagai pigmen. Codex farmasi Inggris menunjukkan pada tahun 1907 penggunaan kadmium iodida sebagai obat untuk mengobati "sendi yang diperbesar", kelenjar scrofulous dan sabañones.
Pada 1930 -an dan 1940 -an, produksi kadmium ditakdirkan ke platinum baja dan besi untuk melindungi mereka dari korosi. Pada 1950 -an, senyawa kadmium digunakan, seperti kadmium sulfida dan kadmium selenide sebagai sumber pigmen merah, oranye dan kuning.
1970-1990
Pada 1970 -an dan 1980 -an ditemukan bahwa kadmium kadmium dan senyawa stearat adalah penstabil PVC, yang menghasilkan peningkatan permintaan kadmium. Namun, peraturan lingkungan karena toksisitas kadmium.
Pada 1980-an dan 1990-an, kadmium berhenti menggunakan banyak aplikasinya, tetapi kemudian produksinya meningkat dengan penciptaan baterai yang dapat diisi ulang dari kadmium nikel, yang datang untuk mewakili 80 % dari konsumsi kadmium di Amerika Serikat.
Dapat melayani Anda: penggunaan dan aplikasi alceansSifat fisik dan kimia kadmium
Penampilan
Diserahkan dan abu -abu -abu -abu putih. Menjadi rapuh dengan paparan 80 ºC, bisa memotong dengan pisau. Ditempa dan gulungan dapat dibentuk dengannya.
Berat atom standar
112.414 u
Nomor Atom (Z)
48
Kategori elemen
Posting -transisi logam, secara bergantian dianggap sebagai logam transisi. Definisi IUPAC dari logam transisi adalah yang atom yang memiliki subkap yang tidak lengkap atau yang dapat menyebabkan kation dengan subkap yang tidak lengkap.
Menurut definisi itu, kadmium bukanlah logam transisi sejak kation CD -nya2+ Ini memiliki orbital 4D yang sepenuhnya penuh dengan elektron (4D10).
Bau
WC
Titik lebur
321.07 ºC
Titik didih
767 ºC
Kepadatan
Suhu sekitar: 8,65 g/cm3
Pada titik leleh (cairan): 7.996 g/cm3
Panas fusi
6.21 kJ/mol
Panas penguapan
99.87 kJ/mol
Kapasitas kalori molar
26.020 J/(mol · k)
Elektronegativitas
1.6 Pada Skala Pauling
Energi ionisasi
Pertama: 867,8 kJ/mol (CD+ gas)
Kedua: 1631.4 kJ/mol (CD2+ gas)
Ketiga: 3616 kJ/mol (CD3+ gas)
Konduktivitas termal
96.6 w/(m · k)
Resistivitas Listrik
72,7 NΩ · m pada 22 ° C
Kekerasan
2.0 pada skala Mohs. Itu adalah logam, meskipun padat, sangat lembut.
Stabilitas
Perlahan dioksidasi oleh udara basah untuk membentuk kadmium oksida, yang menodai kecerahan logamnya. Itu tidak mudah terbakar, tetapi dalam bentuk debu itu dapat membakar dan mengalami penandatangan diri.
Pengarahan diri sendiri
250 ºC untuk kadmium adalah bentuk debu.
Indeks bias
1.8 hingga 20 ºC
Reaktivitas
Kadmium dapat terbakar di udara untuk membentuk kadmium oksida (CAO), debu amorf coklat, sedangkan bentuk kristalnya merah gelap.
Kadmium bereaksi dengan cepat dengan asam nitrat encer, dan perlahan -lahan dengan asam klorida panas. Dia juga mampu bereaksi dengan asam sulfat, tetapi tidak bereaksi dengan alkali. Dalam semua reaksi ini, garam kadmium dari anion yang sesuai terbentuk (CL-) atau oxoanion (tidak3- Dan sebagainya42-).
Struktur dan konfigurasi elektronik
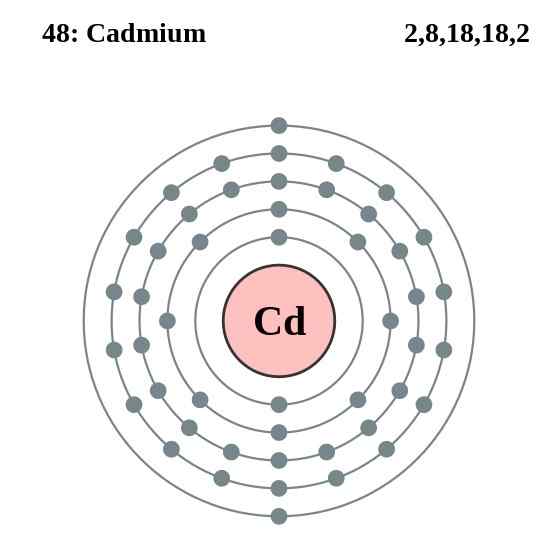 Diagram lapisan elektron kadmium, elemen 48 dalam tabel periodik. Sumber: Pumbaa (karya asli oleh Greg Robson) CC BY-SA 2.0 (http: // createveCommons.Org/lisensi/by-sa/2.0/)
Diagram lapisan elektron kadmium, elemen 48 dalam tabel periodik. Sumber: Pumbaa (karya asli oleh Greg Robson) CC BY-SA 2.0 (http: // createveCommons.Org/lisensi/by-sa/2.0/) Atom kadmium kaca mereka membangun ikatan logam dari elektron valensi mereka, yang terletak di orbital 4D dan 5S sesuai dengan konfigurasi elektronik mereka:
[Kr] 4d10 5S2
Namun, meskipun orbital 4D penuh dengan elektron, dan bahwa juga dapat dianggap bahwa "lautan elektron" berlimpah untuk sangat menganut atom CD, pada kenyataannya interaksi itu lemah. Ini dapat ditunjukkan secara eksperimental dengan titik leleh rendah (321 ºC), dibandingkan dengan logam transisi lainnya.
Oleh karena itu, dan alasan kimia lainnya, kadmium terkadang tidak dianggap sebagai logam transisi. Ada begitu banyak elektron (dua belas) yang terlibat dalam ikatan logam mereka, yang mulai mengganggu penolakan negatif mereka; yang, bersama dengan perbedaan energi antara orbital 4D penuh dan 5S, melemahkan interaksi CD-CD.
Atom CD pada akhirnya mendefinisikan struktur kristal heksagonal kompak (HCP), yang tidak menderita transisi fase sebelum titik lelehnya. Ketika kristal kadmium HCP mengalami tekanan yang setara dengan 10 GPa, strukturnya hanya cacat; Tetapi tanpa melaporkan perubahan fase apa pun.
Angka oksidasi
Kadmium tidak dapat kehilangan dua belas elektron Valencia; Faktanya, Anda bahkan tidak dapat kehilangan salah satu orbital 4D, lebih stabil dalam energi dibandingkan dengan orbital 5S. Oleh karena itu Anda hanya bisa kehilangan dua elektron orbital 5s2, akibatnya logam divalen; Seperti halnya seng, merkuri dan logam alkali (MR. Scholambara).
Saat keberadaan kation CD diasumsikan dalam senyawanya2+, Kemudian dikatakan bahwa kadmium memiliki nomor oksidasi +2. Ini adalah nomor oksidasi utamanya. Misalnya, senyawa berikut mengandung kadmium sebagai +2: CDO (CD2+SALAH SATU2-), Cdcl2 (CD2+Cl2-), Cdso4 (CD2+Sw42-) dan CD (tidak3)2.
Selain angka oksidasi ini, ada juga +1 (CD+) dan -2 (CD2-). Nomor oksidasi +1 diamati dalam cd cd22+, di mana setiap atom kadmium memiliki beban positif. Sementara itu, -2 cukup aneh, dan akan berlaku untuk anion "cadmuro".
Dimana itu dan dapatkan
 Kristal Greenockita. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Kristal Greenockita. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Kadmium adalah elemen langka yang memiliki konsentrasi 0,2 g / ton kerak bumi. Satu -satunya mineral penting kadmium adalah Greenockita (CDS), yang tidak dapat dieksploitasi dari sudut pandang penambangan dan komersial.
Dapat melayani Anda: flokulasi: reaksi, jenis, aplikasi, contohKadmium dikaitkan dengan seng dalam mineral spheny (ZnS), yang biasanya mengandung konsentrasi yang berkisar antara 0,1 % dan 0,3 %; Tetapi dalam beberapa kasus konsentrasi kadmium dalam sphalerite dapat mencapai 1,4 %.
Batuan olahan untuk mendapatkan pupuk fosfor dapat memiliki konsentrasi kadmium 300 mg / kg pupuk. Batubara juga dapat mengandung kadmium kecil, tetapi sejumlah besar.
Sumber penting kadmium adalah emisi vulkanik yang dapat membawa kadmium ke perairan permukaan. Penggunaan pupuk fosfor dalam tanah penggunaan pertanian telah menyebabkan kontaminasi kadmium.
Kadmium yang ada di tanah asam dapat diserap oleh sayuran. Beberapa sayuran digunakan oleh manusia sebagai makanan, yang menjelaskan bagaimana air dan asupan makanan adalah sumber utama pendapatan kadmium pada orang yang tidak terpapar atau merokok secara tidak berprofesi.
Perawatan Sphalerite
Selama penambangan, peleburan dan pemurnian seng yang ada di sphalerite, kadmium biasanya diperoleh sebagai produk sekunder. Peristiwa serupa juga terjadi, meskipun pada tingkat yang jauh lebih rendah, selama tembaga dan pemrosesan timbal.
Demikian juga, sejumlah kecil kadmium dapat diperoleh dari daur ulang limbah besi dan baja.
Sprail mengalami roti panggang sehingga seng sulfida menjadi oksida, zno. Reaksi yang sama diderita oleh kadmium sulfida:
2 Zns + 3 o2 → 2 Zno + 2 Jadi2
Jika campuran oksida ini dipanaskan dengan batubara, mereka akan direduksi menjadi logam masing -masing:
Zno + Co → Zn + Co2
Demikian juga, seng dan kadmium dapat diproduksi dengan elektrolisis saat melarutkan oksida dalam asam sulfat.
Salah satu dari dua metode menghasilkan lima puluh yang terkontaminasi dengan kadmium. Saat meleleh, kadmium dapat disuling dalam ruang hampa karena titik leleh yang lebih rendah (321 ° C) dibandingkan dengan yang dengan CINC (420 ° C).
Isotop
Di antara isotop kadmium alami dan stabil yang kami miliki, dengan kelimpahan masing -masing di bumi:
-106CD (1,25%)
-108CD (0.89%)
-110CD (12,47%)
-111CD (12,8%)
-112CD (24,11%)
-114CD (28,75%)
-113CD (12,23%)
Dia 113CD adalah radioaktif, tetapi karena nilai besar dari setengah kehidupannya (T1/2= 7.7 · 10limabelas bertahun -tahun), dapat dianggap stabil. Dan kemudian ada 116CD, juga radioaktif, dengan setengah kehidupan 3,1 · 1019 Bertahun -tahun, sehingga dapat dianggap sebagai isotop yang stabil, mewakili 7,51 % dari kadmium.
Perhatikan bahwa massa atom rata -rata adalah 112.414 U, lebih dekat 112 dari 114. Keberadaan isotop dominan di atas yang lain tidak diamati pada kadmium.
Risiko
Umum
Penyerapan kadmium terjadi terutama oleh makanan, terutama hati, jamur, kerang, kakao bubuk dan ganggang kering.
Kasus simbol terjadi di Cina pada abad terakhir, di mana ada polusi penting dengan kadmium pada populasi. Polusi kadmium disebabkan oleh konsentrasi padi yang tinggi, disebabkan oleh adanya kadmium dalam tanah budidaya sereal.
Seorang perokok memiliki asupan rata -rata 60 μg / hari. Konsentrasi maksimum kadmium yang diizinkan dalam darah adalah 15 μg / hari. Non perokok memiliki konsentrasi kadmium dalam darah sekitar 0,5 μg / L.
Paru -paru menyerap antara 40 dan 60 % dari kadmium yang ada dalam asap tembakau. Kadmium yang diserap di paru -paru diangkut dalam darah, membentuk kompleks dengan protein, sistein dan glutasi, yang kemudian berakhir di hati, ginjal, dll.
Inhalasi kadmium akut dapat menyebabkan gejala yang mirip dengan yang diamati dalam proses flu; seperti dingin, demam dan nyeri otot, mampu menyebabkan kerusakan paru -paru. Sementara itu, paparan kronis terhadap kadmium dapat menyebabkan penyakit paru -paru, ginjal dan tulang.
Efek pada ginjal
Di ginjal, kadmium biasanya menyebabkan perubahan dalam metabolisme fosfor dan kalsium, dibuktikan dengan peningkatan produksi perhitungan ginjal. Selain itu, itu menyebabkan kerusakan ginjal dimanifestasikan dalam penampilan dalam urin protein pengangkut retinol dan β-2-microglobulin.
Efek reproduksi
Paparan ibu terhadap kadmium dikaitkan dengan berat anak yang rendah saat lahir dan peningkatan tingkat aborsi spontan.
Kerusakan tulang
Kadmium terkait di Jepang dengan keberadaan penyakit Itai -Itai di abad terakhir. Penyakit ini ditandai dengan mineralisasi tulang yang rendah, kerapuhan tulang dengan laju patah tulang yang tinggi, peningkatan osteoporosis dan nyeri tulang.
Dapat melayani Anda: CD3: Karakteristik, fungsiKarsinogenesis
Meskipun eksperimen tikus menjalin hubungan antara kadmium dan kanker prostat, belum ditunjukkan pada manusia. Hubungan antara kadmium dan kanker ginjal telah dibuktikan, dan juga telah dikaitkan dengan kanker paru -paru.
Aplikasi
Bakteri isi ulang nikel-kadmium
 Baterai yang berbeda atau baterai Ni-CD. Sumber: Boffy B via Wikipedia.
Baterai yang berbeda atau baterai Ni-CD. Sumber: Boffy B via Wikipedia. Cadmium hidroksida digunakan sebagai katoda dalam baterai Ni-CD. Ini digunakan dalam industri kereta api dan aeronautika, serta dalam instrumen untuk penggunaan kolektif yang meliputi ponsel, camcorder, laptop, dll.
Konsumsi kadmium untuk elaborasi baterai NI-CD mewakili 80 % dari produksi kadmium. Namun, karena toksisitas elemen ini, baterai Ni-CD secara bertahap digantikan oleh baterai hidrida nikel-logam.
Pigmen
 Kadmium merah. Sumber: Marco Almbauer [domain publik]
Kadmium merah. Sumber: Marco Almbauer [domain publik] Kadmium sulfida digunakan sebagai pigmen kuning dan kadmium seleniuro sebagai pigmen merah, dikenal sebagai cadmio red. Pigmen -pigmen ini ditandai dengan kecemerlangan dan intensitasnya, sehingga mereka telah digunakan dalam plastik, keramik, kaca, enamel dan warna artistik.
Telah ditunjukkan bahwa pelukis Vincent Van Gogh menggunakan pigmen kadmium dalam lukisannya, yang memungkinkannya untuk mencapai berbagai warna merah, oranye, dan kuning cerah.
Warna pigmen kadmium harus dilemahkan sebelum ditumbuk dengan minyak atau dicampur dalam cat air dan akrilik.
Televisi
Komponen yang mengandung kadmium digunakan dalam fosfor televisi hitam dan putih, serta kecocokan biru dan hijau untuk tabung gambar televisi berwarna.
Fosfor adalah bagian dari layar yang dipancarkan oleh sinar katoda, bertanggung jawab atas pembentukan gambar. Kadmium, terlepas dari toksisitasnya, telah mulai digunakan di televisi qled dari kreasi baru -baru ini.
Stabilisasi PVC
Senyawa kadmium yang dibentuk dengan karboksilat, laurerate dan steereate digunakan sebagai penstabil polivinil klorida, karena mereka menunda degradasi yang dihasilkan oleh paparan panas dan sinar ultraviolet yang memecah PVC selama proses pembuatannya.
Karena toksisitas kadmium, sekali lagi, penstabil PVC yang disatukan dengan kadmium telah digantikan oleh penstabil lainnya, seperti barium, kalsium-seng dan organostaño.
Paduan
Kadmium telah digunakan dalam bantalan paduan karena ketahanannya yang tinggi terhadap kelelahan dan koefisien gesekan rendah. Kadmium memiliki titik leleh yang relatif rendah, sehingga digunakan dalam paduan pelelur rendah, dan merupakan komponen selain banyak jenis pengelasan.
Kadmium juga dapat digunakan dalam paduan konduktivitas listrik, konduktivitas termal dan kontak listrik.
Penutup
Kadmium digunakan untuk perlindungan baja, aluminium, dan elemen pemasangan logam non -jimer lainnya, serta suku cadang seluler. Lapisan kadmium memasok perlindungan korosi di media saline dan alkali tersebut. Selain itu, ini berfungsi sebagai pelumas.
Kadmium juga digunakan dalam banyak aplikasi listrik dan elektronik yang membutuhkan ketahanan korosi dan resistivitas listrik yang rendah.
Reaktor nuklir
Kadmium digunakan dalam reaktor nuklir untuk kemampuannya menangkap neutron, yang memungkinkan untuk mengendalikan produk neutron berlebih dari fisi nuklir, menghindari celah nuklir tambahan.
Semikonduktor
Seleniuro dan kadmium telluriuro adalah senyawa yang memenuhi fungsi semikonduktor dalam deteksi cahaya dan dalam sel surya. HGCDTE sensitif terhadap cahaya inframerah dan digunakan sebagai detektor gerakan, serta sakelar untuk perangkat remote control.
biologi
 He-CD Laser Light. Sumber: agak anonim (https: // www.Flickr.com/foto/[Email Protects]/35766549)
He-CD Laser Light. Sumber: agak anonim (https: // www.Flickr.com/foto/[Email Protects]/35766549) Helium-CD mengintervensi pembentukan sinar laser violet biru dari panjang gelombang yang berkisar antara 325 dan 422 nm, dapat digunakan dalam mikroskop fluoresensi.
Kadmium digunakan dalam biologi molekuler untuk memblokir saluran kalsium, tergantung pada potensi membran.
Referensi
- Wikipedia. (2019). Kadmium. Diperoleh dari: di.Wikipedia.org
- Hutan v. R. & et al. (2014). Tekanan tinggi dan struktur suhu CD cair dan padat: Implikasi untuk kurva leleh CD. Pulih dari: risetgate.bersih
- Kata. Dough Stewart. (2019). Fakta Elemen Kadmium. Pulih dari: chemicool.com
- Pusat Nasional Informasi Bioteknologi. (2019). Kadmium. Database pubchem. CID = 23973. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Godt, j., Scheidig, f., Grosse-Siesup, c., Esche, v., Brandenburg, hlm., Reich, a., & Groneberg, D. KE. (2006). Toksisitas kadmium dan bahaya yang dihasilkan untuk kesehatan manusia. Jurnal Kedokteran Kerja dan Toksikologi (London, Inggris), 1, 22. Doi: 10.1186/1745-6673-1-22
- Ros Rachel. (30 Juli 2018). Fakta tentang Camium. Dipulihkan dari: LiveScience.com
- Para editor Eeritlopaedia Britannica. (6 September 2018). Kadmium. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Asosiasi Kadmium Internasional. (S.F.). Aplikasi kadmium. Pulih dari: kadmium.org
- Lentech b. V. (2019). Kadmium. Pulih dari: lentech.com
- « Fungsi node basal, anatomi dan patologi
- Parasitologi sejarah, apa yang Anda pelajari?, Cabang, Konsep »

