Panas pembakaran

- 4193
- 288
- Frederick Pfeffer
Apa panasnya pembakaran?
Dia Panas pembakaran Itu adalah energi yang dilepaskan ketika sejumlah material, biasanya satu mol, bereaksi secara eksotermis dengan oksigen udara. Ini adalah sifat termokimia yang penting dalam karakterisasi bahan bakar, alkohol dan, terutama, hidrokarbon, seperti butana dan metana.
Saat suatu zat membakar cahaya dan panas, energi yang dapat digunakan untuk melakukan pekerjaan pada tubuh lain. Misalnya, panas yang dihasilkan mampu memanaskan volume air yang besar, yang uapnya menekan sekitarnya, bertindak beberapa generator listrik; atau hanya, makanan kukus yang lebih jauh.
 Panas yang dihasilkan oleh pembakaran gas dapur digunakan untuk memanaskan kuali dan makanan
Panas yang dihasilkan oleh pembakaran gas dapur digunakan untuk memanaskan kuali dan makanan Panas pembakaran bervariasi antara semua zat, meskipun sifat kimianya pada dasarnya sama. Variasi ini sesuai dengan stabilitas relatif, yaitu: semakin tidak stabil senyawa, semakin besar energi yang dilepaskan, diwakili sebagai -ΔH. Simbol negatif berarti panas mengalir.
Nilai -ΔH yang berbeda digunakan untuk membandingkan stabilitas relatif antara alkaus yang berbeda dan isomernya. Itu juga memungkinkannya menjadi stabil.
Pengukuran
Untuk mengukur panas pembakaran, diperlukan pompa kalorimetri. Di dalamnya zat bereaksi dengan oksigen dengan aktivasi percikan listrik.
Kemudian, panas yang dilepaskan memanaskan volume air yang mengelilingi kompartemen sampel, mengukur suhu sebelum dan sesudah pembakaran, serta massa air dan bahan bakar.
Jadi, energi yang dilepaskan akan sama dengan:
Ceh2o·MH2Atau · Δt
Di manaeh2o Ini adalah panas spesifik air, 4.184 j/g · ºC, MH2Atau massa air, dan Δt perubahan suhunya. Akhirnya, panas ini, diekspresikan dalam unit Joule atau kalori, dibagi antara massa atau mol bahan bakar yang ditempatkan di dalam pompa kalorimetri, untuk mendapatkan panas pembakaran per unit massa atau mol.
Dapat melayani Anda: Berapa setara dengan mekanis panas?Logam tidak menggabungkan diri, tetapi teroksidasi pada kecepatan yang berbeda tergantung pada suhu di mana mereka terpapar. Panas yang mereka hasilkan tercela untuk diukur dengan cara yang sama seperti yang dilakukan dengan hidrokarbon dan bahan bakar lainnya. Mereka bukan, oleh karena itu, zat yang mudah terbakar.
Energi potensial
Selama pembakaran, tautannya rusak untuk membentuk yang baru, lebih stabil. Energi yang terkandung dalam semua tautan molekul tidak tergantung pada pergerakannya, jadi ada energi potensial.
Semakin besar energi potensial, semakin tidak stabil molekulnya dan, oleh karena itu, akan melepaskan lebih banyak panas setelah tautan baru ditetapkan.
Untuk mengetahui apa tepatnya tautan baru ini, produk pembakaran lengkap harus dipertimbangkan: CO2 Untuk karbon, h2Atau untuk hidrogen, dan tidak2 Untuk nitrogen. Berkenaan dengan hidrokarbon, pembakaran lengkapnya akan menghasilkan campuran stoikiometrik CO2 dan H2SALAH SATU.
Kedua molekul, CO2 dan H2Atau, mereka memiliki energi potensial yang sangat rendah, karena tautannya (O = C = O dan H-O-H) sangat stabil dibandingkan dengan tautan hidrokarbon dari mana mereka berasal (C-H dan C-C).
Stabilitas relatif
Energi potensial secara bebas. Tetapi variasinya bukan, yaitu perbedaan energi antara produk (CO2 dan H2O) dan reaktan (hidrokarbon).
Itulah sebabnya memiliki variasi ini, atau apa yang sama, pembakarannya memanaskan, Anda bisa tahu apa stabilitas relatif antara satu set hidrokarbon atau isomer.
Ditutup
Alkana bisa linier, bercabang atau siklik. Dalam kasus alkana linier, panas pembakarannya bervariasi tergantung pada panjang rantainya; Artinya, itu tergantung pada berapa banyak unit ch2 memiliki. Pertimbangkan contoh N-heksana, N-heptano dan N-oktan:
Itu dapat melayani Anda: yodium: sejarah, sifat, struktur, mendapatkan, risiko, penggunaanCh3(Ch2)4Ch3, -ΔH = 4163 kJ/mol
Ch3(Ch2)5Ch3, -ΔH = 4817 kJ/mol
Ch3(Ch2)6Ch3, -ΔH = 5471 kJ/mol
Anda dapat melihat bahwa pembakarannya dipanaskan bervariasi dengan 654 kJ/mol. Ini berarti bahwa setiap cho2 yang ditambahkan ke rantai meningkatkan panas pembakaran pada tingkat 654 kJ/mol. Jadi, nonano, ch3(Ch2)7Ch3, Ini akan memiliki panas pembakaran yang sama dengan 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Ini sama dengan mengatakan bahwa rantai yang lebih panjang memiliki energi potensial yang lebih besar, dan oleh karena itu, mereka lebih tidak stabil.
Alkana yang diramifikasi lebih stabil daripada linier, dan ini disimpulkan dari panas pembakarannya. Pertimbangkan sekarang kasus tiga isomer oktan:
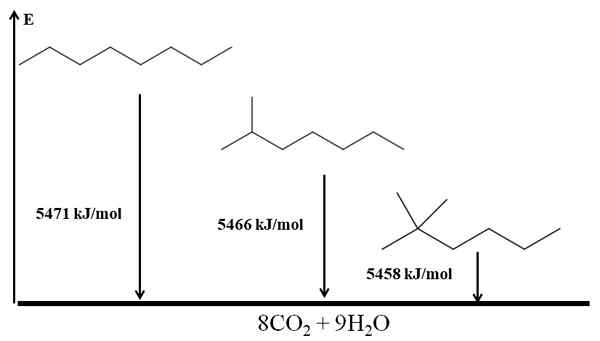 Pemanasan pembakaran untuk tiga isomer oktan. Sumber: Gabriel Bolívar via Molview.
Pemanasan pembakaran untuk tiga isomer oktan. Sumber: Gabriel Bolívar via Molview. Dia N-Octano adalah yang paling tidak stabil karena panas pembakarannya adalah yang terbesar (5471 kJ/mol). Di sisi lain, isomer 2-methylheptano dan 2,2-dimethylhexan. 2,2-dimethylhexan adalah yang paling stabil untuk menjadi yang paling bercabang dari tiga isomer.
Alkena
Stabilitas relatif alkena juga dapat diperoleh dari panas pembakarannya. Pertimbangkan, misalnya, empat isomer butenus:
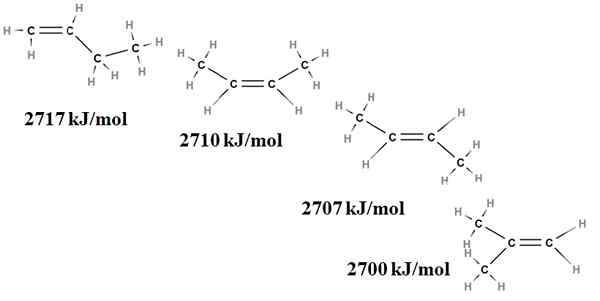 Pembakaran memanaskan untuk isomer buteno. Sumber: Gabriel Bolívar via Molview.
Pembakaran memanaskan untuk isomer buteno. Sumber: Gabriel Bolívar via Molview. Di sini kita tidak lagi berbicara tentang konsekuensi, tetapi tentang tingkat penggantian ikatan rangkap, C = C, dan ketegangan van der Waals; yaitu penolakan elektronik dan sterik antara dua kelompok besar yang terletak di sisi yang sama dari ikatan rangkap.
Isomer pertama, 1-butene, adalah yang paling tidak stabil karena ikatan rangkapnya lebih sedikit diganti (h2C = c). Ini tercermin dalam panas pembakarannya 2717 kJ/mol.
Dapat melayani Anda: asam klorogenikDi sebelah kanan, cis-2-butene, sedikit lebih stabil karena ikatan rangkap lebih banyak diganti. Tetapi trans-2-butene bahkan lebih, karena bahkan jika memiliki tingkat substitusi yang sama, kelompok-kelompok yang didiami3 dari ikatan rangkap berada pada posisi trans, yaitu, pada sisi yang berbeda dari ikatan rangkap. Perhatikan bahwa panas dari trans-2-butene (2707 kJ/mol) hampir tidak sedikit lebih rendah dari cis-2-butene (2710 kJ/mol).
Isomer terakhir, 2-metil-2-butene, yang juga sama-sama diganti sebagai CIS dan Trans 2 Bungeo, namun yang paling tidak stabil dari semua. Ini karena keduanya ch3 Mereka ditemukan di salah satu karbon ikatan rangkap, oleh karena itu menjadi alkena dengan cho3 Geminal.
Senyawa karbonil
Seperti halnya alkos, dan hidrokarbon lainnya secara umum, stabilitas relatif senyawa karbonil (keton, aldehida, asam karboksilat) juga terkait dengan panas pembakarannya.
Dengan demikian, semakin stabil, atau kurang reaktif kelompok mereka c = o, anak di bawah umur akan menjadi pemanas pembakaran mereka.
Misalnya, panas pembakaran Butanal, ch3Ch2Ch2Cho, ini 2475 kJ/mol. Panas ini lebih tinggi dari 2-butanone, ch3Ch2Coch3, yang sama dengan 2442 kJ/mol. Oleh karena itu, butanal lebih tidak stabil daripada 2-butanone.
Di 2-butanon C = O lebih stabil berkat kelompok ch3Ch2 dan ch3; Hal yang tidak terjadi dengan Butan, di mana salah satu kelompok hampir tidak ada atom h.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2020). Panas pembakaran. Diperoleh dari: di.Wikipedia.org
- Yayasan CK-12. Panas pembakaran. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- BBC. (2020). Energi Kimia: Entralpi Pembakaran. Diperoleh dari: BBC.bersama.Inggris
- Steven a. Hardinger. (2017). Glosarium Ilustrasi Kimia Organik: Entalpi Pembakaran. Pulih dari: chem.UCLA.Edu

