Aturan Markovnikov
- 1803
- 257
- Jessie Harvey
Apa aturan Markovnikov?
Itu Aturan Markovnikov Ini adalah aturan empiris, diformulasikan pada tahun 1869 oleh ahli kimia Rusia Vladimir Markovnikov, yang digunakan untuk memprediksi regioselektivitas produk penambahan elektrofilik. Bahkan hari ini masih berlaku, mengungkapkan kesederhanaannya dalam bagaimana mekanisme beberapa reaksi organik datang.
Aturan ini berlaku khusus untuk alkena dalam reaksi hidrohalogenasi mereka. Dengan demikian, memungkinkan untuk memprediksi seperti apa produk mayoritas ketika alkena dan alkin bereaksi dengan HX (HF, HCL, HBR dan HI).
 Penghargaan Aturan Markovnikov dalam hidrohalogenasi propeno. Sumber: V8Rik, CC BY-SA 3.0, via Wikimedia Commons
Penghargaan Aturan Markovnikov dalam hidrohalogenasi propeno. Sumber: V8Rik, CC BY-SA 3.0, via Wikimedia Commons Misalkan misalnya hidrobromasi propeno atau propilena (gambar superior). Aturan Markovnikov memperkirakan bahwa produk mayoritas akan menjadi salah satu di mana atom bromen terkait dengan karbon pusat; Saat dalam produk minor, bromin berakhir dengan karbon ikatan rangkap.
Perhatikan bahwa produk mayoritas memiliki atom hidrogen yang terkait dengan karbon terminal. Poin terakhir ini adalah yang termudah untuk dihafal: hidrogen HX pergi ke karbon ikatan rangkap yang memiliki lebih banyak ikatan hidrogen atau C-H.
Prinsip -prinsip Aturan Markovnikov
Penambahan elektrofilik
Ke ikatan rangkap alkena atau alkine. HX memiliki atom elektron yang buruk, yaitu h, dan atom yang kaya elektron, yaitu x.
Oleh karena itu, HX dapat direpresentasikan sebagai hδ+-Xδ-, menjadi wilayah Hδ+ rentan terhadap penerima elektron, dalam hal ini, ikatan rangkap suatu alkena, terjadi serangan elektrofilik (lihat gambar di bawah).
Dapat melayani Anda: asam fenilasetat: struktur, sifat, penggunaan, efekStabilitas karbokation
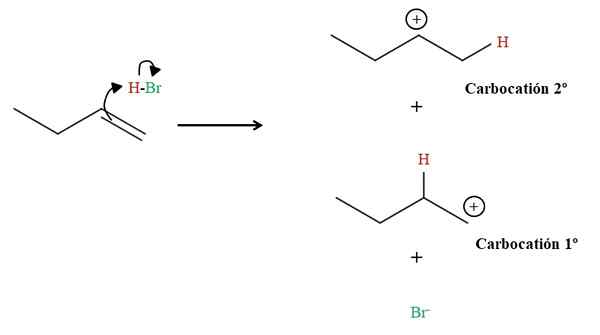
 Pembentukan dua karbokation dalam hidrobromasi 1-butene. Sumber: Gabriel Bolívar via Molview.
Pembentukan dua karbokation dalam hidrobromasi 1-butene. Sumber: Gabriel Bolívar via Molview. Seperti yang dapat dilihat di atas, ikatan rangkap 1-butene menyerang hidrogen HBO. Dengan melakukan itu, elektron ikatan H-BR "terbuka" ke arah atom brom, membentuk karbokasi dan anion br-. Namun, ada kemungkinan membentuk dua karbokation: satu primer (1) dan yang lain sekunder (ke -2).
Setiap karbokasi adalah senyawa perantara dari mana produk akhir akan diperoleh. Ketika ada dua karbokation, kami kemudian akan memiliki dua produk: 2-bromobutano dan 1-bromobutano. BR- Itu bertindak sebagai nukleofil yang menyerang salah satu dari dua karbokation:
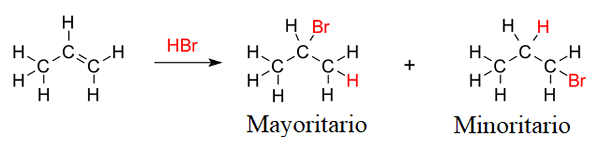
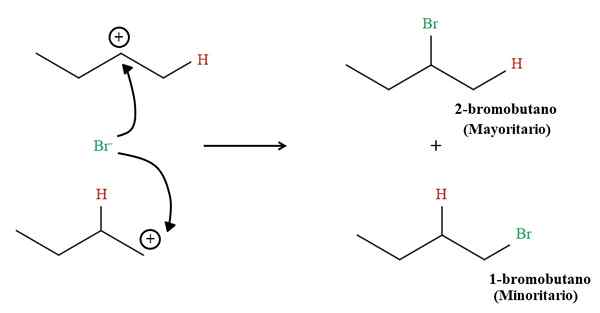 Produk hidrobromasi 1-butene. Sumber: Gabriel Bolívar via Molview.
Produk hidrobromasi 1-butene. Sumber: Gabriel Bolívar via Molview. Tetapi proporsi kedua produk tidak 50%; 2-bromobutano terjadi jauh lebih besar dari 1-bromobutane.
Alasannya adalah bahwa karbokation ke -2 lebih stabil daripada karbokasi pertama, karena beban positifnya lebih baik distabilkan oleh atom karbon yang berdekatan; Sementara dalam karbokation 1, atom hidrogen tidak berkontribusi hampir semua kepadatan elektronik terhadap beban positif itu (untuk induksi atau hiperkonjugasi).
Orang kaya menjadi lebih kaya
Aturan Markovnikov lahir dari pengamatan akhir, dan dari mereka mekanisme yang diilustrasikan di atas dapat dianggap menjelaskannya.
Tanpa perlu selalu menangkap mekanisme ini, atau mengurangi stabilitas karbokasi perantara, aturan sederhana digunakan: dalam penambahan elektrofilik, atom hidrogen diarahkan ke karbon ganda dengan ganda dengan atom hidrogen lebih banyak hidrogen. Dengan demikian, karbon yang paling terhidrogenasi menjadi lebih terhidrogenasi.
Dapat melayani Anda: apa itu anomali air?Di sisi lain, atom X, dalam hal ini BR, berakhir dengan karbon ikatan rangkap yang memiliki lebih banyak ikatan C-C, atau yang lebih digantikan oleh atom lain yang bukan hidrogen. Karena dalam 1-butene karbon terminalnya adalah = cho2, Ini adalah orang yang menerima hidrogen untuk berubah menjadi kelompok -ch3.
Contoh
Kasus aturan Markovnikov yang diterapkan dalam reaksi hidrobromasi terlihat di atas. Ini juga berlaku untuk reaksi hidrokloklininasi, hidroiodasi, hidroaminasi dan hidrasi, baik untuk alkena atau alkine.
Di bagian berikut beberapa contoh tambahan akan dilihat sebagai latihan.
Latihan terpecahkan
Latihan 1
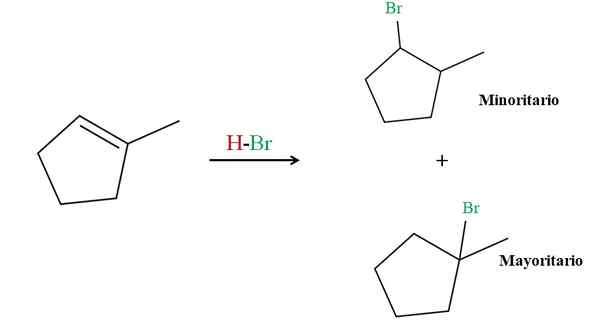 Hidrobromasi 2-metilkiklopenten. Sumber: Gabriel Bolívar via Molview.
Hidrobromasi 2-metilkiklopenten. Sumber: Gabriel Bolívar via Molview. Aturan Markovnikov mengatakan HBR H untuk reaksi atas harus pergi ke karbon ikatan rangkap dengan lebih banyak atom hidrogen. Dalam hal ini, ini sesuai dengan karbon di atas, karena karbon di sebelah kanan, terkait dengan CHO3, Bahkan tidak memiliki atom hidrogen.
Dengan demikian, hidrogen HBR mengarah ke karbon di atas, sedangkan BR akhirnya terkait dengan karbon di sebelah kanan (produk mayoritas). Di sisi lain, jika hidrogen terkait dengan karbon di sebelah kanan, BR diarahkan ke karbon di atas (produk yang lebih rendah).
Perhatikan bahwa produk mayoritas terdiri dari halida ke -3, lebih stabil menurut definisi dan efek stabilisasi dari beban positif parsial; Sedangkan produk minoritas adalah 2nd, halida yang kurang stabil.
Kedua produk, mayoritas dan yang lebih rendah. Jenis produk minoritas ini, melawan aturan Markovnikov, dikenal sebagai produk antimarkovnikov.
Dapat melayani Anda: Referensi Elektroda: Karakteristik, Fungsi, ContohLatihan 2
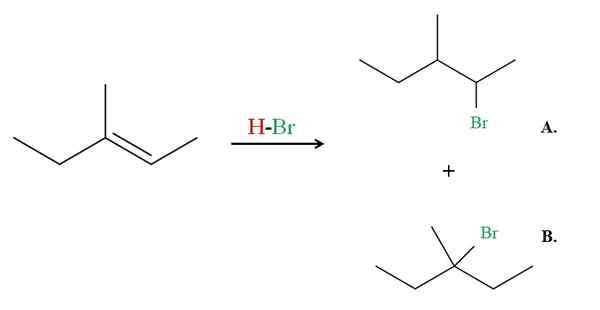 Hidrobromasi 3-metil-2-pentene. Sumber: Gabriel Bolívar via Molview.
Hidrobromasi 3-metil-2-pentene. Sumber: Gabriel Bolívar via Molview. Sekarang lihat contoh 3-metil-2-pentene.
Jika diamati, karbon kanan ikatan rangkap memiliki H, sedangkan yang di sebelah kiri. Oleh karena itu, H dari HBR akan pergi ke karbon itu, karbon harus pergi ke pusat untuk menyebabkan produk B. Produk B adalah mayoritas, karena sekali lagi itu adalah halida ke -3, produk menjadi haluro ke -2.
Latihan 3
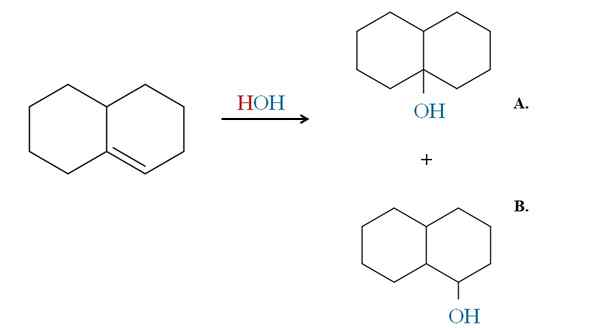 Contoh aturan Markovnikov dalam hidrasi alkena siklus. Sumber: Gabriel Bolívar via Molview.
Contoh aturan Markovnikov dalam hidrasi alkena siklus. Sumber: Gabriel Bolívar via Molview. Contoh sebelumnya akan menghasilkan produk yang sama jika alih -alih HBR akan digunakan HCl dan HI. Hal yang sama sama dengan h2O Dalam reaksi hidrasi yang dikatalisis oleh asam dan panas. Oh datang untuk mengganti atom HX.
Oleh karena itu, aturan Markovnikov memberi tahu kita bahwa dalam penambahan elektrofilik di atas, OH akan pergi ke karbon dari ikatan rangkap yang paling banyak diganti, dengan lebih sedikit hidrogen.
Dengan demikian, produk A adalah mayoritas, dan produk B minoritas. Perhatikan lagi bahwa Produk A adalah alkohol ke -3, dan produk B alkohol ke -2.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2020). Aturan Markovnikov. Diperoleh dari: di.Wikipedia.org
- Steven a. Hardinger. (2017). Ilustrasi Daftar Kimia Organik: Aturan Markovnikov. Pulih dari: chem.UCLA.Edu
- Gamini Gunawardena. (24 Agustus 2020). Aturan Markovnikov. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Para editor Eeritlopaedia Britannica. (17 September 2013). Aturan Markovnikov. Dipulihkan dari: Britannica.com
- Kata. S. Gevorg. (2020). Kimia Organik: Aturan Markovnikov dengan masalah praktik. Pulih dari: chemistroysteps.com

