Pembentukan karbokasi, karakteristik, jenis, stabilitas
- 1307
- 269
- Mr. Darrell Streich
A carbocation, Seperti namanya, itu adalah ion organik yang memiliki atom karbon yang dimuat secara positif, yang ditandai dengan menjadi sangat tidak stabil, ada untuk waktu yang singkat. Biasanya merupakan perantara dalam reaksi organik, yaitu, berasal sebagai langkah yang sangat diperlukan dari mekanisme molekuler masing -masing.
Secara historis ada titik konflik dalam kompresi apa itu karbokation. Ini karena ada simfin molekul reaktif yang, karena alasan tertentu, dapatkan beban positif di salah satu karbon mereka. Karbokasi klasik, untuk berbicara, adalah salah satu yang dapat diwakili oleh formula umum gambar di bawah ini.
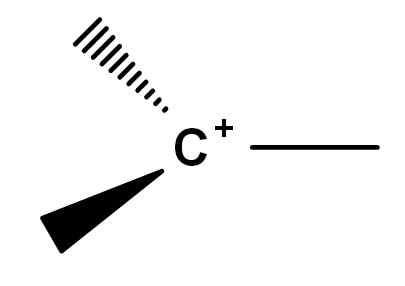 Formula umum karbokasi. Sumber: Gabriel Bolívar.
Formula umum karbokasi. Sumber: Gabriel Bolívar. Perhatikan bagaimana beban positif terletak persis pada atom karbon, dan juga tidak memiliki tautan. Oleh karena itu, karbokasi adalah elektron yang buruk, ini menjadi penyebab reaktivitasnya yang tinggi.
Misalkan metana, cho4. Jika karbon kehilangan salah satu atom hidrogennya, kami akan menghilangkan salah satu dari empat ikatan C-H. Kemudian karbokasi metil berasal, ch3+, yang bisa kita wakili hanya dengan menempatkan atom hidrogen di ujung garis -garis formula atas. Ch3+ Itu adalah yang paling sederhana dari semua karbokation.
[TOC]
Pelatihan
Bagaimana karbokation terbentuk? Jawabannya ditemukan dalam mekanisme reaksi. Namun, sebagian besar berbagi yang sama dari dua dari dua aspek berikut:
-Pecahnya heterolitik
-Penambahan elektron π ke elektrofil
Pecahnya heterolitik
Dalam ruptur heterolitik ikatan C-G, g menjadi atom atau kelompok apa pun, itu rusak dengan cara yang tidak setara: elektron ikatan dibiarkan g, sedangkan atom karbon memperoleh beban positif. Misalnya:
Dapat melayani Anda: Arsenik: Sejarah, Struktur, Properti, Penggunaan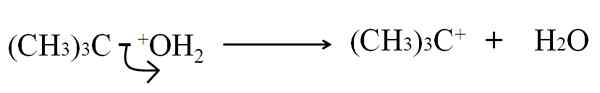 Pecahnya heterolitik pada dehidrasi tertbutanol. Sumber: Gabriel Bolívar.
Pecahnya heterolitik pada dehidrasi tertbutanol. Sumber: Gabriel Bolívar. Sekarang, istirahat ini dapat diberikan untuk beberapa metode, yang pada gilirannya akan mengubah mekanisme dan reaksi yang dipertimbangkan.
Penambahan elektron π ke elektrofil
Proses lain dimana karbokation terbentuk, menjadi sangat umum dalam alkena dan senyawa aromatik, adalah dengan menyerang elektron ikatan rangkap ke elektrofil. Kasus yang paling umum adalah hidrogenasi alkena dengan aksi asam:
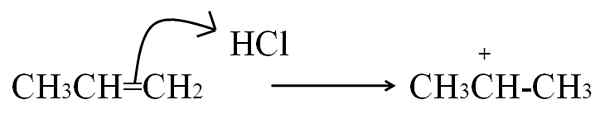 Reaksi HCl dengan propeno untuk membentuk karbokasi sebagai perantara. Sumber: Gabriel Bolívar.
Reaksi HCl dengan propeno untuk membentuk karbokasi sebagai perantara. Sumber: Gabriel Bolívar. Persamaan ini sesuai dengan pembentukan karbokasi, yang itu a perantara, Bukan produk. Elektron ikatan rangkap menyerang hidrogen HCl, elektrofil. Hidrogen ditambahkan ke karbon di sebelah kanan ikatan rangkap, sehingga kelompok -ch terbentuk3, Sementara karbon di sebelah kiri memperoleh beban positif.
Karakteristik
Hibridisasi
Formula umum yang disajikan pada awalnya mengungkapkan geometri datar trigonal di sekitar atom karbon. Ini karena hibridisasi yang diderita oleh orbital atom karbon menjadi orbital SP hibrida2, yang dipisahkan pada sudut 120º. Meskipun tidak diwakili, karbokation memiliki orbital P Murni dan kosong, mampu menerima elektron.
Keasaman
Carbocation adalah spesies asam, baik menurut definisi Brönsted atau Lewis. Muatan positif mereka menuntut elektron atau atom hidrogen yang diberikan. Karena alasan inilah karboksi tidak dapat dibentuk di media yang sangat mendasar, karena mereka akan segera bereaksi untuk berasal dari produk lain.
Stabilitas
Hibridisasi sp2 karbokation membuatnya rentan terhadap serangan spesies kaya dalam elektron. Fitur ini selanjutnya ditekankan oleh keasamannya yang hebat. Akibatnya, karbokation adalah spesies yang sangat reaktif, yang hampir tidak terbentuk dan segera (dalam hitungan nanoseconds) bereaksi untuk menimbulkan produk sebenarnya dari reaksi kimia.
Dapat melayani Anda: Asam Sulfat: Struktur, Sifat, Sintesis, PenggunaanJenis karbokation
Ada beberapa jenis karboksi. Namun, ini dapat diklasifikasikan sebagai berikut:
-Utama
-Sekunder
-Tersier
-Aromatik atau arillos
-Vinyl dan Alilic
Utama
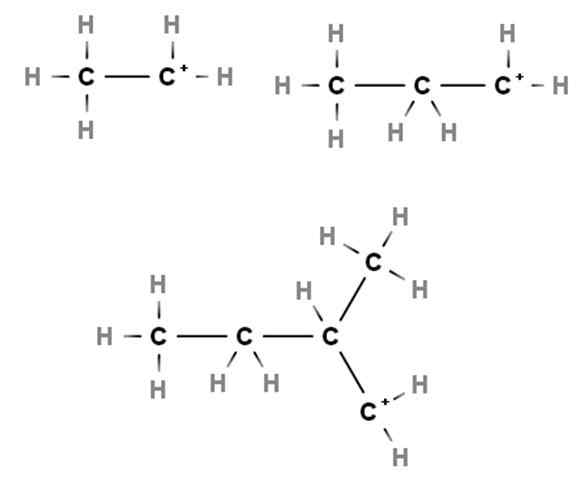 Karbokation primer. Sumber: Gabriel Bolívar via Molview.
Karbokation primer. Sumber: Gabriel Bolívar via Molview. Kedatangan menunjukkan contoh -contoh karbokasi primer. Mereka disebut karena beban positif terletak pada karbon primer, 1, jadi itu hanya terkait dengan atom karbon. Etano, ch3Ch3, Saat H kehilangan salah satu tujuannya, carbocation cho3Ch2+ salah satu +Ch2Ch3.
Sekunder
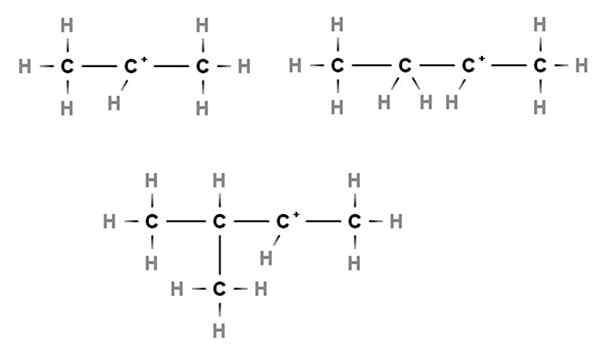 Karbokation sekunder. Sumber: Gabriel Bolívar via Molview.
Karbokation sekunder. Sumber: Gabriel Bolívar via Molview. Dalam karbokasi sekunder, beban positif terletak di karbon sekunder, ke -2, yang terkait dengan dua atom karbon. Misalnya, jika propana, cho3Ch2Ch3, Kami mengambil satu h dari karbon pusat, kami akan memiliki cho karbokation3Ch2+Ch3.
Tersier
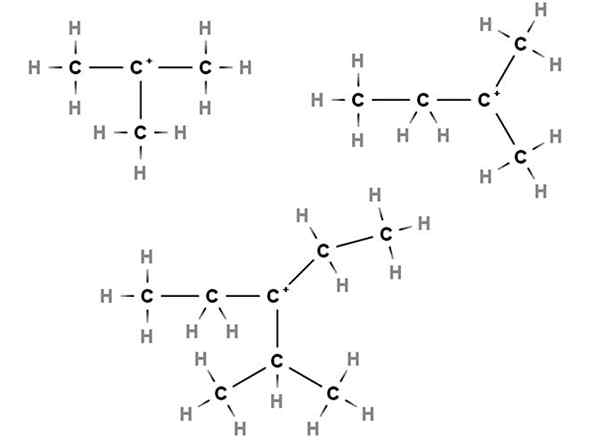 Karbokation tersier. Sumber: Gabriel Bolívar via Molview.
Karbokation tersier. Sumber: Gabriel Bolívar via Molview. Dalam karbokation tersier, beban positif terletak di karbon tersier, ke -3, terkait dengan tiga atom karbon. Perhatikan bahwa tidak seperti dua jenis karbokasi pertama, mereka kekurangan atom hidrogen.
Dengan demikian, kami memiliki methylpropane atau isobutane, ch (ch (pilih3)3, Yang dengan kehilangan hidrogen karbon pusat membentuk karbokasi +C (ch3)3.
Aromatik
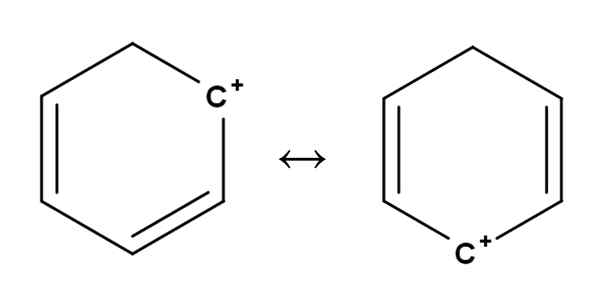 BENZENE CARBOCAT. Sumber: Gabriel Bolívar.
BENZENE CARBOCAT. Sumber: Gabriel Bolívar. Karbokasi aromatik atau aromatik mungkin yang paling istimewa dari semuanya. Pelatihan Anda sangat mirip dengan yang dijelaskan untuk alkena di bagian pertama.
Di dalamnya, beban positif terletak, pada prinsipnya, di salah satu karbon cincin aromatik, seperti benzena. Namun, beban positif tidak diperbaiki, tetapi tersebar di posisi cincin lainnya dengan resonansi.
Itu dapat melayani Anda: ribulosa-1,5-biphosphate (rubp): karakteristik, karbolixationInilah bagaimana beban positif, seperti yang terlihat di atas, beralih dari satu karbon ke karbon lainnya di dalam cincin benzena. Karakteristik ini memberikan stabilitas karbokation ini terhadap jenis karbokasi lainnya.
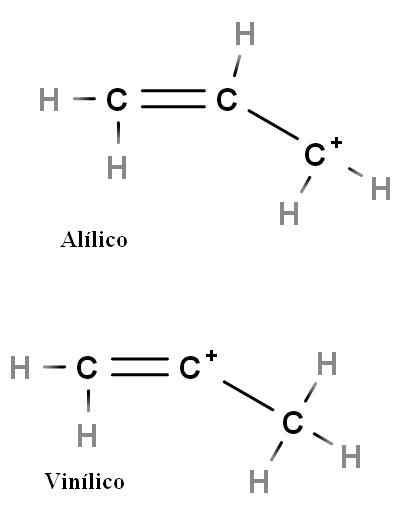
Allylic dan Vinyl
 Karbokation allylic dan vinyl. Sumber: Gabriel Bolívar.
Karbokation allylic dan vinyl. Sumber: Gabriel Bolívar. Jenis karbokation khusus lainnya adalah alilic dan vinyl. Perbedaan di antara mereka (di atas) adalah posisi muatan positif yang terkait dengan ikatan rangkap.
Dalam karbokasi vinil, beban positif ditemukan di salah satu karbon ikatan rangkap; Saat berada dalam karbokasi allyic, beban positif terletak di dalam karbon mengikuti ikatan rangkap. Itu cukup untuk menggantikan hidrogen dengan kelompok lain dan kami akan memiliki keluarga besar karbokation allyic dan vinyl.
Stabilitas relatif
Mengetahui mana yang merupakan jenis utama karboksi, mereka dapat dipesan berdasarkan stabilitas relatifnya:
Vinyl < Primario < Secundario < Alílico < Terciario < Aromático
Sekarang, mungkin ada karbokasi allic yang lebih stabil daripada tersier tertentu. Semuanya akan tergantung pada substituen mereka.
Mengapa stabilitas ini? Dengan kemampuan molekul untuk membubarkan atau mengurangi beban positif karbokasi. Untuk melakukan ini, Anda membutuhkan atom dekat yang memberikan bagian dari kepadatan karbokasi elektronik dengan hiperkonjugasi. Sementara itu, dalam karbokatif alumik dan aromatik ini dicapai dengan resonansi.
Dalam kasus karbokasi vinil, beban positif terletak pada karbon yang sudah SP2, Yang membuatnya sangat tidak stabil.
Referensi
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Carbocation. Diperoleh dari: di.Wikipedia.org
- James Ashenhurst. (20 Februari 2020). 3 faktor yang menstabilkan karboksi. Dipulihkan dari: Masterorganicchemistry.com
- Clark Jim. (2000). Karbokation (atau ion karbonium). Pulih dari: chemguide.bersama.Inggris
- Kata. Kennepohl, Prof. S. Petani & t. Soderberg. (10 Agustus 2020). Struktur dan stabilitas karbokasi. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- « Konsep Kode Etika Lingkungan, Karakteristik dan Contoh
- 4 stasiun tahun ini di Meksiko dan karakteristiknya »

