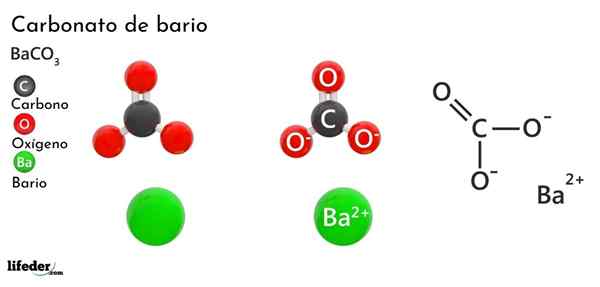
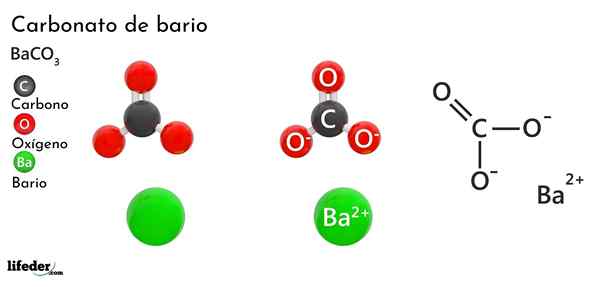
Barium karbonat (BACO3)
- 1625
- 183
- Joseph Nader PhD
Apa itu barium karbonat?
Dia Barium karbonat Ini adalah garam anorganik dari logam bario, unsur kedua dari kelompok 2 dari meja periodik dan yang termasuk dalam logam alkalinotherrous. Formula kimianya adalah Bacchus3 Dan tersedia di pasaran dalam bentuk debu kristal putih.
Bagaimana cara diperoleh? Barium logam ditemukan dalam mineral, seperti barit (baso4) dan Whiterite (Bacchus3). Whiterite dikaitkan dengan mineral lain yang tetap menjadi tingkat kemurnian pada kristal putihnya dengan imbalan warna.
Untuk menghasilkan Bacchus3 Penggunaan sintetis perlu untuk menghilangkan kotoran Whiterite, seperti yang ditunjukkan oleh reaksi berikut:
Bacchus3(s, tidak murni) + 2nh4Cl (s) + q (panas) => BACL2(aq) + 2nh3(g) + h2Atau (l) + co2(G)
Bacl2(aq) + (nh4)2BERSAMA3(s) => bacchus3(s) + 2nh4Cl (aq)
Barita, bagaimanapun, adalah sumber utama barium, dan itulah sebabnya produksi industri senyawa barium mulai dari ini. Mineral ini mensintesis barium sulfida (BAS), suatu produk dari mana sintesis senyawa lain dan aliran Bacchus mengalir3:
BAS (S) + NA2BERSAMA3(s) => bacchus3(s) + na2H.H)
BAS (S) + CO2(g) + h2Atau (l) => bacchus3(S) + (NH4)2S (aq)
Properti Bario Carbonate
 Debu barium karbonat
Debu barium karbonat Itu adalah berdebu, putih dan kristal. Toilet, terurai dan berat molekulnya adalah 197,89 g/mol. Ini memiliki kepadatan 4,43 g/ml dan tekanan uap yang tidak ada.
Ini memiliki laju pembiasan 1.529, 1.676, dan 1.677. Witherita memancarkan cahaya saat menyerap radiasi ultraviolet: dari cahaya putih terang dengan nada kebiruan, hingga cahaya kuning.
Sangat tidak larut dalam air (0,02 g/l) dan dalam etanol. Dalam larutan asam HCl membentuk garam bario klorida yang larut (BACL2), yang menjelaskan kelarutannya dalam media asam ini. Dalam kasus asam sulfat, memicu bagaimana basa garam yang tidak larut4.
Dapat melayani Anda: beryl oxide (beeo)Bacchus3(s) + 2hcl (aq) => BACL2(aq) + co2(g) + h2Atau (l)
Bacchus3(s) + h2Sw4(aq) => baso4(s) + co2(g) + h2Atau (l)
Karena ini adalah padatan ionik, ia juga tidak larut dalam pelarut apolar. Barium karbonat meleleh pada 811 ºC; Jika suhu meningkat sekitar 1380-1400 ºC, cairan asin menderita dekomposisi kimia alih-alih mendidih. Proses ini terjadi untuk semua karbonat logam: MCO3(s) => mo (s) + co2(G).
Dekomposisi termal
Bacchus3(s) => bao (s) + co2(G)
Jika padatan ionik ditandai dengan menjadi sangat stabil, mengapa karbonat rusak? Apakah logam mengubah suhu di mana padatan rusak? Ion yang membentuk barium karbonat adalah BA2+ dan co32-, keduanya tebal (yaitu, dengan radio ionik besar). CO32- Dia bertanggung jawab atas dekomposisi:
BERSAMA32-(s) => o2-(g) + co2(G)
Ion oksida (atau2-) Logam terkait dengan logam, oksida logam. Mo menghasilkan struktur ion baru di mana, sebagai aturan umum, semakin mirip ukuran ionnya, semakin stabil struktur yang dihasilkan (entalpi jaringan). Sebaliknya terjadi jika ion m+ SAYA2- Mereka memiliki radio ionik yang sangat tidak setara.
Jika entalpi jaringan besar, reaksi dekomposisi disukai secara energik, membutuhkan suhu pemanasan yang lebih rendah (titik didih lebih rendah) minor) Minor).
Di sisi lain, jika MO memiliki entalpi jaringan kecil (seperti dalam kasus Bao, di mana BA2+ Itu memiliki radio ionik yang lebih besar dari atau2-) Dekomposisi kurang disukai dan membutuhkan suhu yang lebih tinggi (1380-1400ºC). Dalam kasus MGCO3, Maling3 dan srco3, Mereka mogok pada suhu yang lebih rendah.
Dapat melayani Anda: magnesium: riwayat, struktur, sifat, reaksi, penggunaanStruktur kimia
Co anion32- Ini memiliki ikatan rangkap yang beresonansi antara tiga atom oksigen, dua dari ini bermuatan negatif untuk menarik kation BA2+.
Sementara kedua ion dapat dianggap sebagai bidang yang dimuat, CO32- Ini memiliki geometri trigonal datar (segitiga datar yang digambar oleh tiga atom oksigen), mungkin menjadi "bantalan" negatif untuk BA2+.
Ion -ion ini berinteraksi secara elektrostatis untuk membentuk susunan kristal dari jenis ortorrhrombik, menjadi ikatan ionik yang dominan.
Dalam hal ini, mengapa Bacchus tidak larut3 Di dalam air? Penjelasannya hanya didasarkan pada fakta bahwa ion lebih stabil dalam jaringan kristal, daripada terhidrasi oleh lapisan molekul bola air.
Dari sudut lain, molekul air membuatnya sulit untuk mengatasi atraksi elektrostatik yang kuat antara kedua ion. Di dalam jaringan kristal ini mereka dapat menampung kotoran yang memberi warna pada kristal putih mereka.
Aplikasi
Sekilas, bagian Bacchus3 Ini mungkin tidak menjanjikan aplikasi praktis dalam kehidupan sehari -hari, tetapi jika ada kristal mineral wititerit, putih seperti susu, mulai masuk akal mengapa permintaan ekonominya.
Digunakan untuk memproduksi gelas barium atau sebagai aditif untuk memperkuatnya. Ini juga digunakan dalam pembuatan kaca optik.
Karena jaringannya yang hebat dan entalpi kelilin, ini digunakan dalam pembuatan berbagai jenis paduan, karet, katup, lantai lantai, lukisan, keramik, pelumas, plastik, lemak dan semen.
Ini juga digunakan sebagai racun untuk tikus. Singkatnya, garam ini digunakan untuk menghasilkan senyawa barium lainnya, dan dengan demikian berfungsi sebagai bahan perangkat elektronik.
Dapat melayani Anda: asam sulfanil: struktur, sifat, sintesis, penggunaanBacchus3 Ini dapat disintesis sebagai nanopartikel, mengekspresikan skala yang sangat kecil sifat menarik baru dari wititer. Nanopartikel ini digunakan untuk menembus permukaan logam, khususnya katalis kimia.
Telah ditemukan untuk meningkatkan katalis oksidasi, dan entah bagaimana mendukung migrasi molekul oksigen dengan permukaannya.
Mereka dianggap sebagai alat untuk mempercepat proses di mana oksigen dimasukkan. Dan akhirnya, mereka digunakan untuk mensintesis bahan supramolekul.
Risiko
Bacchus3 Ini beracun karena konsumsi, menyebabkan ketidakterbatasan gejala yang tidak menyenangkan yang menyebabkan kematian karena gagal pernapasan atau henti jantung; Karena alasan ini tidak disarankan untuk diangkut di sebelah barang yang dapat dimakan.
Itu menghasilkan kemerahan mata dan kulit, selain batuk dan sakit tenggorokan. Ini adalah senyawa beracun, meskipun mudah dimanipulasi dengan tangan kosong jika konsumsi dihindari di semua biaya.
Itu tidak mudah terbakar, tetapi pada suhu tinggi itu rusak membentuk bao dan rekan2, Produk beracun dan mengoksidasi yang dapat membuat bahan lain terbakar.
Dalam organisme, barium disimpan dalam tulang dan jaringan lain, menggantikan kalsium dalam banyak proses fisiologis. Itu juga memblokir saluran tempat kio kin+, mencegah difusi melalui membran sel.
Referensi
- Pubchem. (2018). Barium karbonat. Diperoleh pada 24 Maret 2018, dari Pubchem: Pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2017). Barium karbonat. Diperoleh pada 24 Maret 2018, dari Wikipedia: In.Wikipedia.org
- Buku Kimia. (2017). Barium karbonat. Diperoleh pada 24 Maret 2018, dari Chemicalbook: Chemicalbook.com
- Robbins Manuel a. (1983).Buku Mineral Fluorescent Robbins The Collector. Deskripsi Mineral Fluorescent, P-117.
- Shiver & Atkins. (2008). Kimia anorganik. Di dalam Struktur padatan sederhana (edisi keempat., P. 99-102). MC Graw Hill.