Struktur kalsium karbonat, sifat, pembentukan, penggunaan

- 3491
- 914
- Miss Wm Hudson
Dia kalsium karbonat Ini adalah senyawa anorganik yang formula kimianya adalah Caco3. Ini terutama ditemukan dalam mineral seperti kalsit dan aragonit. Demikian juga, batu kapur menyusun, batuan sedimen di mana mineral kalsita hadir.
Karbonat logam penting ini diperoleh secara industri dengan ekstraksi dan penggilingan mineral yang mengandungnya; Untuk tujuan ini, marmer terutama digunakan. Proses lain terletak pada penggunaan kalsium oksida, yang menjadi kalsium hidroksida, mengendapkan kalsium karbonat dengan penambahan karbon dioksida. Dengan cara ini kristal diperoleh dari berbagai ukuran.
 Shell siput terutama terdiri dari kalsium karbonat. Sumber: Pixabay.
Shell siput terutama terdiri dari kalsium karbonat. Sumber: Pixabay. Mereka juga dapat digunakan untuk produksi industri CACO3, Dalam skala kecil, cangkang kerang, cangkang telur dan cangkang tiram di mana ia hadir.
Kalsium karbonat hadir dalam batu kapur dilarutkan oleh karbon dioksida dalam air, menghasilkan kalsium bikarbonat. Tindakan ini dapat menyebabkan gua -gua dan merupakan penyebab alkalinasi air; peristiwa yang sangat penting dalam pemeliharaan kehidupan di dalamnya.
Ini telah digunakan dalam konstruksi dan elaborasi patung; Contohnya adalah mitra Athena, Katedral Krakow, dan patung Abraham Lincoln di Washington. Namun, kerentanannya terhadap hujan asam telah mengurangi penggunaannya dalam konstruksi.
Kalsium karbonat telah memiliki banyak aplikasi di industri sebagai bahan pengisi plastik dan kertas. Dalam kedokteran telah digunakan untuk mengendalikan keasaman lambung; sebagai suplemen kalsium makanan; untuk mengendalikan fosfata pada pasien dengan gagal ginjal kronis, dll.
[TOC]
Struktur
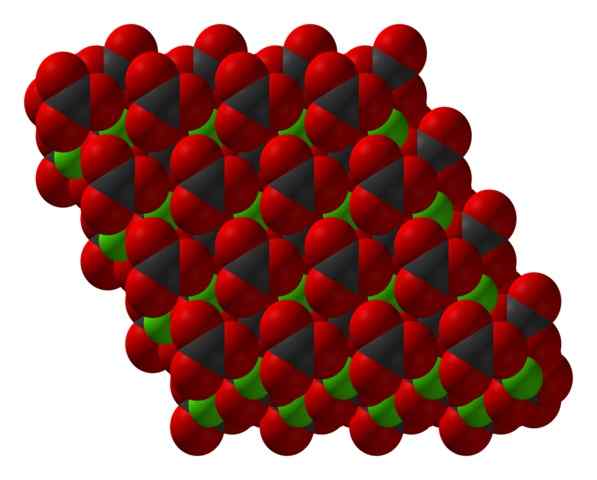 Struktur kristal Chanco3 diwakili dengan model pengisian ruang. Sumber: CCOIL [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Struktur kristal Chanco3 diwakili dengan model pengisian ruang. Sumber: CCOIL [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Formula kalsium karbonat, caco3, menunjukkan bahwa proporsi antara ion Ca2+ dan co32- Ini 1: 1; yaitu, untuk setiap CA2+ Ada CO32- rekan berinteraksi secara elektrostátical dengannya. Dengan demikian, ikatan ionik akhirnya memiliki ion -ion ini untuk membentuk pola struktural yang mendefinisikan kristal.
Dalam gambar superior struktur CACO ditampilkan3. Bola hijau sesuai dengan kation2+, dan bidang merah dan hitam ke anion co32-. Perhatikan bahwa struktur tampaknya dibentuk oleh beberapa lapisan: salah satu kalsium, dan satu lagi karbonat; yang berarti mengkristal dalam struktur heksagonal yang ringkas.
Ini dapat melayani Anda: Ammonium chloride (NH4CL)Fase heksagonal ini (β-caco3) Sesuai dengan polimorf. Ada dua lainnya: Ortorombic (λ-caco3) dan heksagonal yang bahkan terpadat (μ-caco3). Gambar yang lebih rendah membantu untuk memvisualisasikan segi enam bahagia dengan lebih baik:
 Struktur heksagonal kalsit. MaterialScientist di Wikipedia Inggris [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Struktur heksagonal kalsit. MaterialScientist di Wikipedia Inggris [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Namun, tergantung pada suhu (dan untuk garam ini tekanan) ion dalam getarannya disesuaikan dengan struktur lain; Ini adalah polimorf yang disebutkan di atas (β, λ dan μ).
Karena kedengarannya tidak diketahui, kecuali mereka disebutkan dengan nama mineralogi mereka di bagian berikutnya.
Kekerasan protein
Kristal Caco3 Mereka tidak sendirian: mereka dapat meng -host kotoran seperti kation logam lain yang mewarnai warna; o Protein, menggabungkan matriks organik yang entah bagaimana berkontribusi pada kekerasan alaminya.
Protein mengurangi ketegangan yang dialami oleh kristal satu sama lain sebelum tekanan atau dampak. Sebagai? Saat diselingi di antara kristal, bertindak seolah-olah itu adalah "pad" (mirip dengan lady bata-semen).
Itulah sebabnya senyawa atau mineral ini bersifat biokompatibel, dan tidak terkejut bahwa itu adalah bagian dari kuku, cangkang laut, kerang atau tulang landak. Ini telah menjadi sumber inspirasi bagi mereka yang berdedikasi untuk mengembangkan materi baru.
Properti
Nama lain
-Aragonit
-Calcito
-Volterite
-Susu kalsium
-Papan tulis
-Marmer
Masa molar
100.086 g/mol.
Deskripsi Fisik
Toilet debu putih.
Rasa
Mirip dengan kapur, hambar.
Fusion dan titik didih
Itu rusak karena melepaskan co2 Bahkan sebelum mencair atau mendidih.
Kelarutan
Praktis tidak larut dalam air dan alkohol. Itu dilarutkan dengan efervesensi dalam asam asetat dan hidroklorat yang diencerkan. Hydroxides Namun, mereka mengurangi kelarutan mereka. Sementara itu, garam amonium dan karbon dioksida meningkatkan kelarutan kalsium karbonat dalam air.
Kepadatan
2.7 hingga 2.95 g/cm3.
Penguraian
Sekitar 825 ºC dipecah menjadi kalsium oksida (kapur) dan karbon dioksida (CO2).
ph
8 hingga 9
Indeks bias
-1.7216 hingga 300 nm dan 1.6584 hingga 589 nm (calcita).
-1.5145 hingga 300 nm dan 1.4864 hingga 589 nm (aragonit).
Ketidakcocokan
Dengan asam, aluminium dan garam amonium.
Entalpi fusi
36 kJ/mol pada 800 ºC (kalsit).
Dapat melayani Anda: molaritas: konsentrasi, unit, perhitungan, latihanKonstanta produk kelarutan
3.36 · 10-9 pada 25 ºC.
Kekerasan
-3.0 (kalsit)
-3.5 - 4.0 (aragonit) pada skala Mohs.
Transisi fase
Aragonit adalah metastabil dan perubahan yang tidak dapat diubah menjadi kalsit saat memanaskannya di udara kering menjadi 400 ºC.
Reaktivitas
Kalsium karbonat bereaksi dengan asam, melepaskan karbon dioksida, kalsium ionik dan air.
Kalsium karbonat dikombinasikan dengan air jenuh dengan karbon dioksida, setara dengan asam karbonat (h2BERSAMA3), Untuk membentuk kalsium bikarbonat.
Pelatihan
Kapur, marmer dan batu kapur, dua mineral pertama dan bahan berbatu yang ketiga, mengandung kalsium karbonat dan berasal dari sedimen, mereka dianggap dibentuk oleh sedimentasi siput selama jutaan tahun selama bertahun -tahun.
PH bisa menjadi faktor terpenting dalam pembentukan polimorf pada suhu 24 ° C. Vaterita adalah produk utama dalam kisaran pH antara 8,5 dan 10; Aragonit adalah pH 11; dan kalsit ke ph> 12.
Diketahui juga bahwa banyak alga air segar membangun kristal kalsit saat tumbuh di lingkungan jenuh kalsium. Selain itu, mikroalga mampu menyebabkan presipitasi kalsium karbonat.
Bentuk kalsium karbonat
Pada gambar di bawah ini, tiga bentuk utama atau polimorf akan ditampilkan untuk kalsium karbonat:
 Calcita Crystal. Sumber: Parent Géry [Domain Publik]
Calcita Crystal. Sumber: Parent Géry [Domain Publik] Kristal aragonit. Sumber: Battistini Riccardo [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Kristal aragonit. Sumber: Battistini Riccardo [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Kristal Vaterita. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Kristal Vaterita. Sumber: Rob Lavinsky, irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Dari atas ke bawah adalah polimorf kalsit, aragonit dan vaterita. Perhatikan perbedaan antara morfologi kristal mereka (warnanya khas dari asal -usul dan karakteristik lingkungannya).
Vaterita lebih buram daripada kalsit, yang terakhir menjadi lengkap. Sementara itu, kristal aragonit menyerupai monolit memanjang kecil.
Jika sampel dari ketiga polimorf ini diamati di bawah mikroskop elektronik, kristal mereka (nada keabu -abuan karena teknik ini tidak memungkinkan resolusi warna), morfologi yang sama akan ditemukan seperti dalam skala makroskopik; itu, pada pandangan pertama.
Di antara ketiga polimorf ini, kalsit adalah yang paling melimpah dan stabil, diikuti oleh aragonit, dan akhirnya vaterita, yang paling langka dari bentuk caco3
Dapat melayani Anda: kalorimetri: studi dan aplikasi apaAplikasi
Industrialis
Kalsium karbonat meningkatkan resistensi terhadap torsi dan traksi karet sintetis dan alam, mempertahankan fleksibilitasnya. Ini digunakan dalam industri konstruksi sebagai bahan semen dan sebagai bahan baku untuk kapur. Penggunaannya telah berkurang karena rusak oleh hujan asam.
Kalsium karbonat digunakan dalam pemurnian besi. Dalam bentuk jeruk nipis menghilangkan sulfur dioksida yang ada dalam logam. Pemurnian gula bit digunakan. Itu digunakan sebagai kapur untuk batu tulis, tetapi telah digantikan oleh plester untuk aplikasi ini.
Kalsium karbonat dicampur dengan dempul yang digunakan dalam penempatan kaca. Tanah digunakan sebagai bahan pengisi dalam film mikropor yang digunakan di popok. Ini juga digunakan sebagai bahan pengisi dalam plastik seperti PVC. Selain itu, kekuatan plastik meningkat.
Kalsium karbonat digunakan untuk meningkatkan kapasitas cakupan lukisan. Ini digunakan sebagai bahan pengisi kertas karena lebih murah daripada serat kayu, mampu mewakili lebih dari 10% kertas.
Dokter
Ini digunakan sebagai antasid untuk memerangi hiperakiditas lambung dan mengurangi gangguan pencernaan. Ini digunakan sebagai suplemen kalsium makanan dan dalam pengobatan dan pencegahan osteoporosis. Ini digunakan dalam pengobatan hiperfosfatia pada pasien dengan gagal ginjal kronis.
Ini telah digunakan untuk mengurangi efek inhibitor protease yang tidak diinginkan yang digunakan dalam pengobatan HIV, mengamati pada pasien pengurangan diare.
Ini menghasilkan penurunan tekanan darah pada wanita hamil dengan hipertensi dan preeklampsia, karena keduanya dapat dikaitkan dengan peningkatan permintaan kalsium karena keberadaan janin.
Yang lain
Kalsium karbonat digunakan dalam pertanian sebagai pupuk dan untuk memerangi keasaman tanah. Ini digunakan sebagai pengawet, penahan warna, dan menegaskan kembali makanan.
Selain itu, ini merupakan bahan pasta gigi, dan berfungsi sebagai debu yang abrasif dalam pembersihan dan pencucian.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Kalsium karbonat. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). Kalsium karbonat. Database pubchem., CID = 10112. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Kai-Yin Chong, Chin-Hua Chia, dan Sarani Zakaria. (2014). Polimorphs kalsium karbonat pada reaksi suhu. Prosiding Konferensi AIP 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 November 2016). Menemukan kristal karbonat howum mendapatkan kekuatan. Menguntungkan pemasaran bisnis. Pulih dari: rdmag.com
- Elemen Amerika. (2019). Kalsium karbonat. Diperoleh dari: Amerika.com
- Elsevier. (2019). Kalsium karbonat. Ilmiah. Diperoleh dari: Scientedirect.com
- Buku Kimia. (2017). Kalsium karbonat. Dipulihkan dari: Chemicalbook.com

