Karbon

- 2482
- 544
- Ernesto Mueller
Apa itu karbon?
Dia karbon Ini adalah elemen kimia non -metalik yang simbol kimianya c. Namanya adalah karena batubara, sayuran atau mineral, di mana atom -atomnya mendefinisikan berbagai struktur. Ini membentuk berbagai senyawa organik dan anorganik, dan juga menampilkan dirinya dalam sejumlah besar alotrop.
Karbon ditemukan pada semua makhluk hidup; Semua biomolekulnya berutang keberadaannya pada stabilitas dan kekuatan ikatan C-C dan kecenderungannya yang tinggi untuk menyatukan. Itu adalah unsur kehidupan, dan dengan atom mereka, tubuh mereka dibangun.
Senyawa organik yang dibangun oleh biomaterial terdiri dari kerangka berkarbonasi dan heteroatom. Ini dapat dilihat pada pandangan pertama di kayu pohon; Dan juga, saat petir jatuh pada mereka dan Rostiza. Padatan hitam inert yang tersisa juga memiliki karbon; Tapi itu adalah batu bara sayur.
Sifat karbon
Sifat fisik atau kimia yang ditemukan dalam padatan, mineral atau bahan karbon tunduk pada banyak variabel. Di antara mereka adalah: komposisi atau tingkat kotoran, hibridasi atom karbon, keragaman struktur, dan morfologi atau ukuran pori -pori.
Ketika sifat -sifat karbon menggambarkan, sebagian besar teks atau sumber bibliografi didasarkan pada grafit dan berlian.
Karena? Karena mereka adalah alotrop yang paling terkenal untuk elemen ini dan mewakili padatan atau bahan kemurnian tinggi; Artinya, mereka secara praktis dibuat tidak lebih dari atom karbon (meskipun dengan struktur yang berbeda, seperti yang akan dijelaskan di bagian berikut).
Sifat -sifat batubara sayuran dan mineral berbeda dalam asal atau komposisi mereka, masing -masing. Misalnya, lignit (karbon buruk) sebagai bahan bakar gatea dibandingkan dengan antrasit (kaya karbon). Dan apa yang harus dikatakan tentang alotrop lainnya: nanotube, fullerenos, graphene, graphos, dll.
Namun, mereka secara kimiawi memiliki titik yang sama: mereka teroksidasi dengan kelebihan oksigen di CO2:
C + SALAH SATU2 => Co2
Sekarang, kecepatan atau suhu yang mereka butuhkan untuk mengoksidasi adalah sendiri untuk masing -masing alotrop ini.
Graphite vs Diamond
Di sini komentar singkat juga akan dibuat mengenai berbagai properti untuk kedua alotrop ini:
 Tabel di mana beberapa sifat dari dua kristal alotrop karbon dibandingkan. Sumber: Gabriel Bolívar.
Tabel di mana beberapa sifat dari dua kristal alotrop karbon dibandingkan. Sumber: Gabriel Bolívar. Struktur dan konfigurasi elektronik
Hibridasi
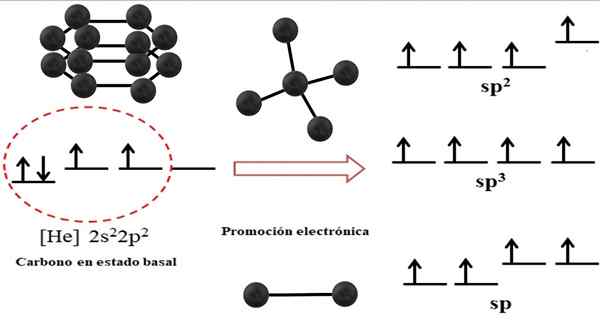 Hubungan antara orbital hibrida dan kemungkinan struktur untuk karbon. Sumber: Gabriel Bolívar.
Hubungan antara orbital hibrida dan kemungkinan struktur untuk karbon. Sumber: Gabriel Bolívar. Konfigurasi elektronik untuk atom karbon adalah 1s22s22 p2, juga ditulis sebagai [dia] 2s22 p2 (gambar atas). Representasi ini sesuai dengan status basal: atom karbon diisolasi dan ditangguhkan dalam kekosongan yang tidak dapat berinteraksi dengan orang lain.
Dapat melayani Anda: struktur kristalDisebutkan bahwa salah satu orbital 2p tidak memiliki elektron, yang menerima elektron orbital energi yang lebih rendah dengan promosi elektronik; Dan dengan demikian, atom memperoleh kemampuan untuk membentuk hingga empat ikatan kovalen melalui empat orbital hibrida SP -nya3.
Perhatikan bahwa keempat orbital SP3 Mereka mengalami kemunduran dalam energi (selaras pada tingkat yang sama). Orbital P Murni lebih energik, itulah sebabnya mereka berada di atas orbital hibrida lainnya (di sebelah kanan gambar).
Jika ada tiga orbital hibrida, itu karena orbital tetap ada P tanpa hibridisasi; Oleh karena itu, mereka adalah tiga orbital sp2. Dan ketika ada dua orbital hibrida ini, dua orbital P Mereka tersedia untuk membentuk ikatan ganda atau tiga, menjadi hibridisasi karbon F.
Aspek elektronik seperti itu sangat penting untuk dipahami mengapa karbon dapat ditemukan dalam infinities alotrop.
Angka oksidasi
Sebelum melanjutkan struktur, bukan orang lain untuk menyebutkan bahwa, mengingat konfigurasi elektronik Valencia 2s22 p2, Karbon dapat memiliki angka oksidasi berikut: +4, +2, 0, -2 dan -4.
Karena? Angka -angka ini sesuai dengan asumsi bahwa ada ikatan ionik sehingga Anda membentuk ion dengan beban masing -masing; yaitu, C4+, C2+, C0 (netral), c2- dan C4-.
Agar karbon memiliki jumlah oksidasi positif, ia harus kehilangan elektron; Dan untuk melakukannya, itu harus dikaitkan dengan atom yang sangat elektronegatif (seperti oksigen).
Sementara itu, agar karbon memiliki bilangan oksidasi negatif, ia harus mendapatkan elektron yang terhubung ke logam atau atom elektronegatif yang lebih rendah daripada dia (seperti hidrogen).
Masalah oksidasi pertama, +4, berarti bahwa karbon telah kehilangan semua elektron valensi; Orbital 2s dan 2p kosong. Jika orbital 2p kehilangan dua elektronnya, karbon akan memiliki nomor oksidasi +2; Jika Anda memenangkan dua elektron, Anda akan memiliki -2; Dan jika dia memenangkan dua elektron lagi menyelesaikan oktetnya dari Valencia, -4.
Contoh
Misalnya, untuk CO2 Jumlah oksidasi karbon adalah +4 (karena oksigen lebih elektronegatif); sementara untuk cho4, adalah -4 (karena hidrogen kurang elektronegatif).
Dapat melayani Anda: hidrazin: struktur, sifat, sintesis, penggunaanUntuk ch3Oh, angka oksidasi karbon adalah -2 (+1 untuk h dan -2 untuk O); Sedangkan untuk hcooh, itu +2 (periksa jumlah 0).
Keadaan oksidasi lain, seperti -3 dan +3, juga mungkin, terutama ketika datang ke molekul organik; Misalnya, pada kelompok metil, -ch3.
Geometri molekuler
Dalam gambar superior, tidak hanya hibridisasi orbital untuk atom karbon ditunjukkan, tetapi juga geometri molekul yang dihasilkan ketika beberapa atom (bola hitam) terkait dengan pusat. Atom sentral ini untuk membuang lingkungan geometris tertentu di ruang angkasa, harus memiliki masing -masing hibridisasi kimia yang diizinkan.
Misalnya, untuk tetrahedron karbon pusat memiliki hibridisasi SP3; Karena itu adalah pengaturan yang paling stabil untuk empat hibrida SP3. Dalam kasus karbon SP2, Mereka dapat membentuk tautan ganda dan membuang lingkungan datar trigonal; Jadi, segitiga ini mendefinisikan segi enam yang sempurna. Dan untuk hibridisasi SP, karbon mengadopsi geometri linier.
Dengan demikian, geometri yang diamati dalam struktur semua alotrop hanya diatur di tetrahedra (SP3), segi enam atau pentagon (sp2), dan garis (sp).
Tetrahedra mendefinisikan struktur 3D, sementara segi enam, pentagon dan garis, struktur 3D atau 2D; Yang terakhir menjadi pesawat atau lembaran yang mirip dengan dinding lebah lebah:
 Dinding dengan desain heksagonal lebah lebah analogi dengan bidang yang terdiri dari karbon SP2. Sumber: Pixabay.
Dinding dengan desain heksagonal lebah lebah analogi dengan bidang yang terdiri dari karbon SP2. Sumber: Pixabay. Dan jika kita melipat dinding heksagonal ini (pentagonal atau dicampur), kita akan mendapatkan tabung (nanotube) atau bola (fullerene), atau sosok lain. Interaksi antara angka -angka ini menimbulkan morfologi yang berbeda.
Padatan amorf atau kristal
Meninggalkan geometri, hibridisasi, atau morfologi dari kemungkinan struktur karbon, padatan mereka dapat mengklasifikasikan secara global menjadi dua jenis: amorf atau kristal. Dan di antara dua klasifikasi ini alotrop mereka didistribusikan.
Karbon amorf hanyalah yang menyajikan campuran sewenang -wenang tetrahedra, segi enam atau garis, tidak dapat menetapkan pola struktural; Begitulah kasus batubara, sayuran atau batubara yang diaktifkan, kokas, jelaga, dll.
Sedangkan karbon kristal terdiri dari pola struktural yang dibentuk oleh salah satu geometri yang diangkat; Misalnya, berlian (jaringan tetrahedra tiga dimensi) dan grafit (lembaran heksagonal bertumpuk).
Dapat melayani Anda: natrium nitrat (nano3): struktur, sifat, penggunaan, risikoDimana karbon?
Selain menjadi elemen kimia yang umum dalam semua bentuk kehidupan, karbon di alam hadir dalam tiga bentuk kristal: berlian, grafit dan panduan.
Ada juga beberapa bentuk mineral batubara amorf (antrasit, lignit, bodoh, gambut), bentuk cair (varietas minyak bumi) dan soda (gas alam).
Aplikasi
Sekali lagi, seperti sifat dan struktur, penggunaan atau aplikasi konsisten dengan alotrogo atau bentuk mineralogi karbon. Namun, ada generalisasi tertentu yang dapat disebutkan, selain beberapa poin yang sangat dikenal. Begitulah:
-Karbon telah digunakan sejak lama sebagai zat pereduksi mineral dalam mendapatkan logam murni; Misalnya, besi, silikon dan fosfor, antara lain.
-Ini adalah landasan kehidupan, dan kimia organik dan biokimia adalah studi tentang refleksi ini.
-Itu juga merupakan bahan bakar fosil yang memungkinkan mesin pertama untuk pergi ke roda gigi mereka. Dengan cara yang sama, gas karbon untuk sistem pencahayaan lama diperoleh darinya. Batubara identik dengan cahaya, panas dan energi.
-Dicampur sebagai aditif dengan zat besi dalam proporsi yang berbeda memungkinkan penemuan dan peningkatan baja.
-Warna hitamnya terjadi dalam seni, terutama grafit dan semua tulisan yang dibuat dengan sapuan mereka.
Risiko dan tindakan pencegahan
Karbon dan padatannya tidak mewakili risiko kesehatan apa pun. Yang khawatir tentang tas batubara? Mereka menjualnya ke banyak di aula beberapa pasar, dan selama tidak ada api dekat, blok hitam mereka tidak akan terbakar.
Coke, di sisi lain, dapat mewakili risiko jika kandungan belerangnya tinggi. Saat pembakaran akan melepaskan gas belerang yang, selain menjadi beracun, berkontribusi pada hujan asam. Dan meskipun CO2 Dalam jumlah kecil itu tidak bisa mencekik kita, itu berdampak besar pada lingkungan sebagai gas rumah kaca.
Dari perspektif ini, karbon adalah bahaya "jangka panjang", karena pembakarannya mengubah iklim planet kita.
Dan dalam arti yang lebih fisik, padatan atau bahan karbon jika disemprotkan dengan mudah diangkut dengan arus udara; Dan akibatnya, mereka diperkenalkan langsung ke paru -paru, yang dapat merusaknya.
Sisanya, sangat umum untuk mengonsumsi "batu bara" saat beberapa makanan sedang memasak.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.

