Karbon 12 Notasi Nuklir, Sejarah, Komentar
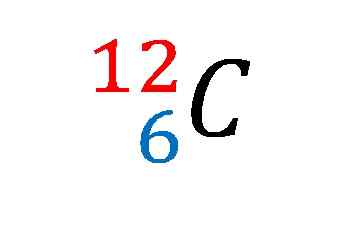
- 4750
- 1186
- Tommie Smith
Dia Karbon-12 Ini adalah isotop paling berlimpah dari elemen karbon, dengan kelimpahan 98,93%. Selain itu, ini bertanggung jawab utama untuk semua properti dan aplikasi yang dikaitkan dengan elemen karbon.
Dia 12C Dengan massa atom tepat 12 Dalton, ini berfungsi sebagai referensi untuk pembentukan massa atom dari sisa nukleid. Atom 12C terdiri dari enam proton, neutron dan elektron; Namun, massa elektron dianggap dapat diabaikan.
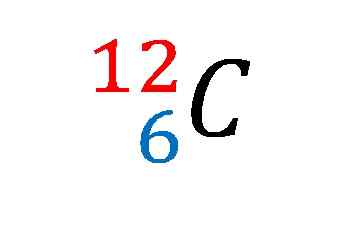 Notasi nuklir untuk isotop karbon-12. Sumber: Gabriel Bolívar
Notasi nuklir untuk isotop karbon-12. Sumber: Gabriel Bolívar Elemen biasanya memiliki massa atom yang dinyatakan sebagai bilangan bulat, diikuti oleh desimal, karena elemen dapat memiliki beberapa isotop stabil.
Oleh karena itu, massa atom elemen dinyatakan sebagai rata -rata tertimbang dari massa atom dari isotop yang berbeda. Dengan mempertimbangkan bahwa 12C memiliki kelimpahan 98,93%, dan 13C kelimpahan 1,15%, massa atom karbon adalah 12.011 Dalton.
Massa atom suatu unsur dinyatakan sebagai rata -rata massa atom dari atom yang berbeda dalam kaitannya dengan dua belas bagian dari massa dari 12C, dikenal sebagai unit unifikasi massa atom; sebelumnya disingkat sebagai "Uma", dan saat ini sebagai "u".
[TOC]
Notasi nuklir
Pada gambar atas notasi atau simbol nuklir untuk isotop karbon-12 ditampilkan.
Menggambarkannya sama dengan duduk karakteristik atom karbon par excellence. Nomor atomnya 6 menunjukkan jumlah proton dalam nukleusnya. Angka 12 sama dengan jumlah proton dan neutron, dan karena itu tentang massa atom; yang sebanding dengan massa nuklir.
Dapat melayani Anda: besi oksidaDan meskipun notasi ini tidak menunjukkannya, ada 6 elektron yang menangkal beban positif proton dalam nukleus. Dari sudut pandang ikatan kimia, empat dari enam elektron ini adalah yang menetapkan fondasi kehidupan seperti yang kita kenal.
Sejarah
Investigasi Dalton (1810) menunjukkan bahwa air mengandung persentase oksigen 87,7% dan 12,5% hidrogen. Tapi, Dalton mengatakan formula air itu oh. Davy dan Berzelius (1812) mengoreksi formula air ke h2SALAH SATU.
Selanjutnya, Berzelius menemukan komposisi air berikut: oksigen 88,8% dan hidrogen 11,2%. Dia menganggap bahwa berat atom hidrogen adalah 1 g, dan oksigen 16 g.
Kemudian, mereka menyadari bahwa dengan menggunakan berat atom 1 g untuk hidrogen, berat atom oksigen adalah 15,9 g. Alasan ini, antara lain, mengarah untuk menetapkan massa atom 16 g oksigen sebagai standar referensi untuk massa atom dari unsur kimia yang berbeda.
Oksigen digunakan sebagai pola referensi dari akhir abad ke -19 hingga 1961, ketika diputuskan untuk menggunakan karbon sebagai standar referensi untuk pembentukan massa atom dari berbagai elemen yang berbeda.
Sebelum 1959, IUPAP dan IUPAC menggunakan elemen oksigen untuk menentukan mol dengan cara berikut: 1 mol adalah jumlah atom oksigen yang ada dalam 16 g.
Komentar umum
Berbicara tentang 12C akan merujuk pada karbon secara keseluruhan; atau setidaknya, 98% dari esensinya, yang cukup untuk perkiraan seperti itu. Itulah sebabnya isotop ini tidak memiliki penggunaan itu sendiri, sedangkan elemen seperti itu, dan padatan yang mengintegrasikan ratusan aplikasi.
Dapat melayani Anda: solusi yang dihargaiNamun, harus dicatat bahwa organisme hidup memiliki preferensi khusus untuk isotop ini yang menurut 13C; yaitu persentase dari 13C atau hubungannya 12C/13C bervariasi tergantung pada ekosistem, daerah, atau spesies hewan.
Ini mungkin disebabkan oleh fakta bahwa molekul dengan terlalu banyak atom 13C, lebih berat, menghambat atau membahayakan proses metabolisme dan fungsi sel -sel tubuh; bahkan jika persentase dari 13C pada makhluk hidup itu sedikit lebih tinggi dari 1%.
Oleh karena itu, 12C adalah isotop karbon yang bertanggung jawab untuk hidup. Dan 14C "meter waktu" dari jasadnya, berkat peluruhan radioaktifnya.
Utilitas tidak langsung lainnya 12C adalah menciptakan "kontras" untuk teknik spektroskopi resonansi magnetik nuklir 13C, dengan mana struktur berkarbonasi senyawa organik dapat dijelaskan (temukan dan bangun).
Referensi
- Phillips, Basil. (8 Juli 2019). Apa isotop karbon yang harus umum? Ilmu pengetahuan.com. Pulih dari: ilmuwan.com
- César Tomé López. (2019). Bobot atom. Diperoleh dari: CulturAcientifica.com
- Elsevier. (2019). Karbon-12. Ilmiah. Diperoleh dari: Scientedirect.com
- R. mengirimkan. (S.F.). Notasi nuklir. Pulih dari: hyperphysics.Phy-astr.GSU.Edu
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- « Karakteristik kelompok karbonil, properti, nomenklatur, reaktivitas
- Heriberto frías biografi, gaya, karya »

