Karakteristik kelompok karbonil, properti, nomenklatur, reaktivitas
- 3576
- 966
- Irvin Reichel
Dia Grup Karbonil Ini adalah kelompok fungsional organik dan teroksigenasi yang menyerupai molekul gas karbon monoksida. Ini direpresentasikan sebagai C = O, dan meskipun dianggap organik, itu juga dapat ditemukan dalam senyawa anorganik; Seperti asam karbonat, h2BERSAMA3, atau dalam senyawa organetalik dengan CO sebagai ikatan.
Namun, dalam kimia karbon, kehidupan, biokimia dan cabang ilmiah analog lainnya di mana kelompok ini menonjol karena kepentingannya yang sangat besar. Jika bukan karena dia, banyak molekul tidak dapat berinteraksi dengan air; Protein, gula, asam amino, lemak, asam nukleat dan biomolekul lainnya tidak akan ada jika bukan karena itu.
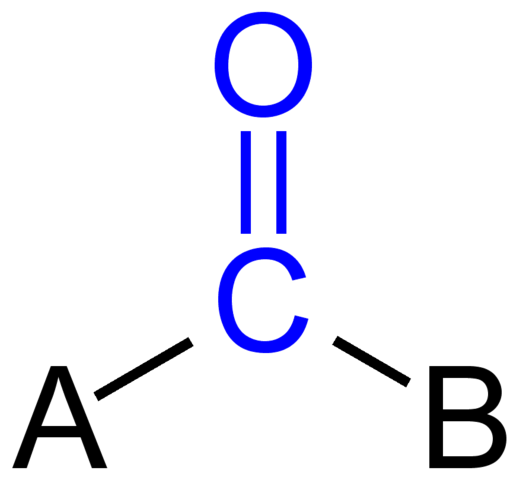
 Grup Karbonil. Sumber: Jü [domain publik]
Grup Karbonil. Sumber: Jü [domain publik] Gambar atas menunjukkan bagaimana kelompok ini terlihat di kerangka umum senyawa. Perhatikan bahwa itu disorot oleh warna biru, dan jika kita menghapus penggantian A dan B (R atau R ', sama validnya), akan ada molekul karbon monoksida. Kehadiran substituen ini mendefinisikan sejumlah besar molekul organik.
Jika A dan B adalah atom karbon, seperti logam atau unsur non -metalik, senyawa organometalik atau anorganik dapat dibuat. Dalam kasus kimia organik, substituen A dan B akan selalu atau atom hidrogen, garis berkarbonasi, dengan atau tanpa konsekuensi, siklik, atau cincin aromatik.
Dengan demikian, itu mulai memahami mengapa kelompok karbonil cukup umum bagi mereka yang mempelajari ilmu alam atau kesehatan; Itu ada di mana -mana, dan tanpanya mekanisme molekuler yang terjadi di sel kita tidak akan terjadi.
Jika relevansinya dapat diringkas, akan dikatakan bahwa ia memberikan polaritas, keasaman, dan reaktivitas terhadap molekul. Di mana ada kelompok karbonil, kemungkinan besar pada saat itu molekul dapat menderita transformasi. Oleh karena itu, ini adalah situs strategis untuk mengembangkan sintesis organik melalui oksidasi atau serangan nukleofilik.
[TOC]
Karakteristik dan sifat kelompok karbonil
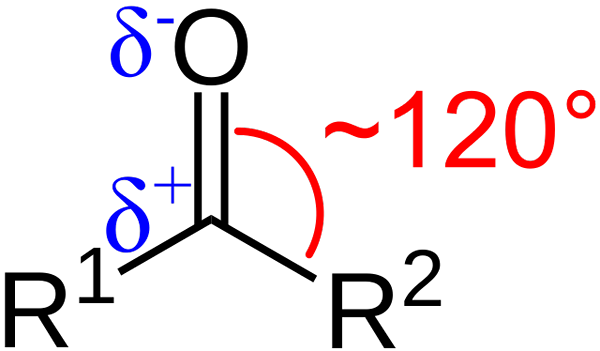 Karakteristik Struktural Kelompok Karbonil. Sumber: Azaline Gomberg [Domain Publik].
Karakteristik Struktural Kelompok Karbonil. Sumber: Azaline Gomberg [Domain Publik]. Apa karakteristik struktural dan elektronik dari kelompok karbonil? Ke atas1 dan r2 bukannya A dan B, yang ada antara substituen dan atom oksigen sudut 120 ° C; Artinya, geometri di sekitar grup ini adalah trigonal flat.
Apa geometri seperti itu2; Dengan demikian, karbon akan memiliki tiga orbital sp2 Untuk membentuk tautan kovalen sederhana dengan r1 dan r2, dan orbital P murni untuk membangun ikatan rangkap dengan oksigen.
Dengan cara ini dijelaskan bagaimana bisa ada ikatan rangkap C = O.
Jika gambar diamati, juga akan terlihat bahwa oksigen memiliki kepadatan elektronik yang lebih besar, Δ-, daripada karbon, δ+. Ini karena oksigen lebih elektronegatif daripada karbon, dan karenanya "mencuri" kepadatan elektronik; Dan tidak hanya untuknya, tetapi juga untuk substituen R1 dan r2.
Akibatnya, momen dipol permanen dihasilkan, yang dapat memiliki besarnya lebih besar atau lebih kecil tergantung pada struktur molekul. Di mana ada kelompok karbonil, akan ada momen dipol.
Struktur resonansi
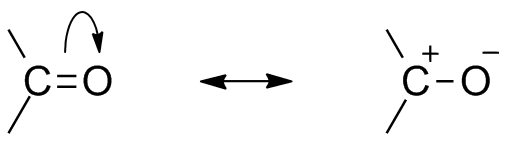 Dua struktur resonansi untuk kelompok organik ini. Sumber: Mfomich [CC0]
Dua struktur resonansi untuk kelompok organik ini. Sumber: Mfomich [CC0] Konsekuensi lain dari elektronegativitas oksigen adalah bahwa pada kelompok karbonil ada struktur resonansi yang mendefinisikan hibrida (kombinasi dua struktur gambar superior). Perhatikan bahwa pasangan elektron dapat bermigrasi ke orbital P oksigen, yang meninggalkan atom karbon dengan beban parsial positif; Sebuah karbokasi.
Dapat melayani Anda: sikloalcanos: sifat, reaksi, penggunaan, contohKedua struktur terjadi secara konstan, jadi karbon mempertahankan defisiensi elektron yang konstan; yaitu, untuk kation yang sangat dekat dengan itu mereka akan mengalami tolakan elektrostatik. Tapi, jika itu adalah anion, atau spesies yang mampu menyumbangkan elektron, itu akan merasakan daya tarik yang kuat untuk karbon ini.
Lalu apa yang dikenal sebagai serangan nukleofilik terjadi, yang akan dijelaskan di bagian berikutnya.
Tata nama
Ketika sebuah senyawa memiliki kelompok C = O, dikatakan bahwa itu adalah karbonil. Dengan demikian, tergantung pada sifat senyawa karbonil, ia memiliki aturan nomenklatur sendiri.
Meskipun, terlepas dari apa itu, semua orang berbagi aturan yang sama: c = o memiliki prioritas dalam rantai berkarbonasi pada saat daftar atom karbon.
Ini berarti bahwa jika ada konsekuensi, atom halogen, kelompok fungsional nitrogenik, tautan ganda atau tiga, tidak ada yang dapat membawa jumlah yang lebih kecil dari C = O; Oleh karena itu, rantai terpanjang mulai terdaftar sedekat mungkin dengan kelompok karbonil.
Jika sebaliknya ada beberapa C = atau dalam rantai, dan salah satunya adalah bagian dari kelompok fungsional hierarki yang lebih besar, maka kelompok karbonil akan membawa locator yang lebih besar dan akan disebut sebagai substituen OXO.
Dan apa yang dikatakan hierarki? Berikut ini, dari tertinggi ke minor:
-Asam karboksilat, rcooh
-Ester, rcoor '
-Amida, rconh2
-Aldehyde, RCOH (atau RCHO)
-Cetona, rcor
Mengganti R dan R 'dengan segmen molekuler, senyawa karbonil tanpa akhir yang diwakili oleh keluarga di atas: asam karboksilat, ester, amidas, dll. Masing -masing telah mengaitkan nomenklatur tradisional atau IUPAC.
Reaktivitas
Serangan nukleofilik
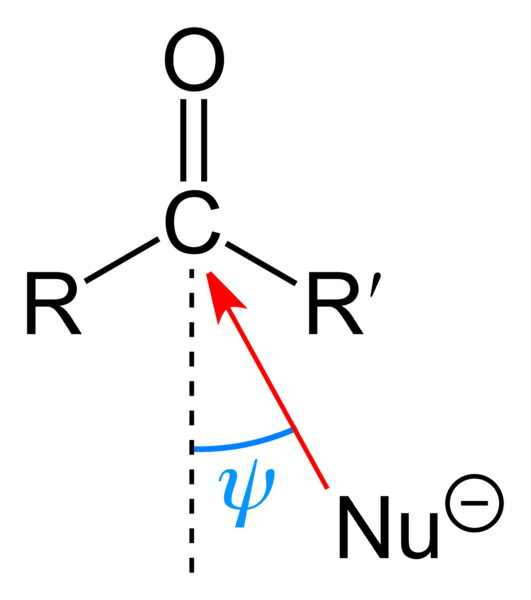 Serangan nukleofilik pada kelompok karbonil. Sumber: Benjah-BMM27 [Domain Publik]
Serangan nukleofilik pada kelompok karbonil. Sumber: Benjah-BMM27 [Domain Publik] Gambar atas menunjukkan serangan nukleofilik yang diderita oleh kelompok karbonil. Nukleofil, Nu-, Ini bisa berupa anion atau spesies netral dengan elektron yang tersedia; Seperti amonia, NH3, Misalnya. Ini terlihat secara eksklusif untuk karbon karena, menurut struktur resonansi, ia menghadirkan beban parsial yang positif.
Beban positif menarik Nu-, yang akan berupaya mendekati "sisi" sehingga ada sedikit penghalang sterik oleh substituen r dan r '. Tergantung seberapa besar mereka, atau ukuran NU yang sama-, Serangan akan terjadi pada sudut yang berbeda ψ; Itu bisa sangat terbuka atau tertutup.
Setelah serangan terjadi, senyawa perantara akan dibentuk, nu-cr'-o-; yaitu, oksigen tetap dengan beberapa elektron untuk memungkinkan NU ditambahkan- ke kelompok karbonil.
Oksigen yang dimuat secara negatif ini dapat melakukan intervensi dalam langkah -langkah lain dari reaksi; Proton sebagai kelompok hidroksil, oh, atau lepaskan seperti molekul air.
Dapat melayani Anda: koefisien partisi: distribusi, distribusi, aplikasiMekanisme yang terlibat, serta produk reaksi yang diperoleh dengan serangan ini, sangat bervariasi.
Turunan
Agen nubliic nu- Bisa jadi banyak spesies. Untuk setiap spesifik untuk bereaksi dengan kelompok karbonil, turunan yang berbeda.
Misalnya, ketika agen nukleofilik tersebut adalah amina, NH2A, iminas berasal, r2C = nr; Jika hydroxylamine, NH2Oh, hasil dalam oximas, rr'c = noh; Jika itu adalah anion sianida, CN-, Cianohydrinas, rr'c (OH) CN, dan dengan demikian dengan spesies lain.
Pengurangan
Awalnya dikatakan bahwa kelompok ini beroksigen, dan karenanya, berkarat. Ini berarti bahwa, mengingat kondisinya, tautan dapat dikurangi atau kehilangan atom oksigen menggantikannya dengan hidrogen. Misalnya:
C = o => ch2
Transformasi ini menunjukkan bahwa gugus karbonil dikurangi menjadi gugus metilen; Ada gain hidrogen karena kehilangan oksigen. Dalam istilah kimia yang lebih tepat: senyawa karbonil dikurangi menjadi alkana.
Jika itu cetona, rcor ', di hadapan hydraracina, h2N-NH2, dan lingkungan yang sangat mendasar dapat dikurangi menjadi alkana masing -masing; Reaksi ini dikenal sebagai reduksi Wolff-Kishner:
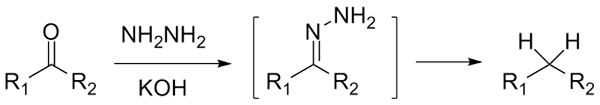 Pengurangan Wolff-Kishner. Sumber: Jü [CC0]
Pengurangan Wolff-Kishner. Sumber: Jü [CC0] Jika di sisi lain campuran reaksi terdiri dari seng amalgamat dan asam klorida, reaksi ini dikenal sebagai reduksi clemmensen:
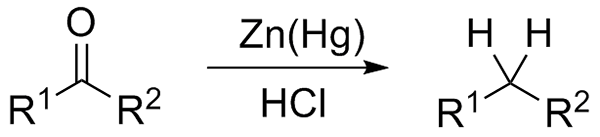 Pengurangan Clemmensen. Sumber: Wikimedia Commons.
Pengurangan Clemmensen. Sumber: Wikimedia Commons.
Pelatihan Acetal dan Ceal
Kelompok karbonil tidak hanya dapat menambahkan agen nukleofilik NU-, Tetapi dalam kondisi asam juga dapat bereaksi dengan alkohol melalui mekanisme yang sama.
Ketika aldehida atau cetona sebagian bereaksi dengan alkohol, hemiacetal atau hemicetals berasal. Jika reaksi dilakukan sepenuhnya, produknya adalah asetal dan ketal. Persamaan kimia berikut merangkum dan mengklarifikasi yang baru disebutkan:
Rcho + r3Oh g rchoh (atau3) (Hemiacetal) + r4Oh g rch (atau3) (Atau4) (Acetal)
Rcor2 + R3Oh g rcor2(Oh) (atau3) (Hemical) + r4Oh g rcor2(Atau3) (Atau4) (Ketal)
Reaksi pertama sesuai dengan pembentukan hemiacetal dan asetal dari aldehida, dan yang kedua dari hemicetal dan keton dari keton.
Persamaan ini tidak cukup sederhana untuk menjelaskan pembentukan senyawa ini; Namun, untuk pendekatan pertama terhadap subjek, cukup untuk memahami bahwa alkohol ditambahkan, dan bahwa rantai samping mereka r (r (r3 dan r4) Mereka terkait dengan karbon karbonil. Itulah mengapa atau atau3 dan atau4 Ke molekul awal.
Perbedaan utama antara asetal dan ketal, adalah adanya atom hidrogen yang terkait dengan karbon. Perhatikan bahwa keton tidak memiliki hidrogen ini.
Teman-teman
Sangat mirip seperti yang dijelaskan di bagian nomenklatur untuk kelompok karbonil, tipenya didasarkan pada substituen apa pun A dan B, atau R dan R '. Oleh karena itu, ada karakteristik struktural yang berbagi serangkaian senyawa karbonil hanya di luar urutan atau jenis tautan.
Misalnya, disebutkan dibuat dengan prinsip analogi antara kelompok ini dan karbon monoksida, Cunjungi. Jika molekulnya tidak memiliki atom hidrogen dan jika ada juga dua terminal C = O, itu akan menjadi karbon oksida, cNSALAH SATU2. Untuk N sama dengan 3, Anda akan memiliki:
Dapat melayani Anda: isóbarosO = c = c = c = o
Yang seolah -olah ada dua molekul C versio yang dihubungkan dan dipisahkan oleh karbon.
Senyawa karbonil tidak hanya dapat berasal dari gas CO, tetapi juga dari asam karbonat, h2BERSAMA3 atau oh- (c = o) -oh. Di sini keduanya mewakili r dan r ', dan mengganti salah satu dari mereka, atau hidrogennya, turunan asam karbononat diperoleh.
Dan kemudian ada turunan dari asam karboksilat, rcooh, diperoleh dengan mengubah identitas R, atau mengganti H dengan atom atau rantai lain (yang akan menimbulkan ester, rcoor ').
Cara mengidentifikasinya di aldehida dan keton
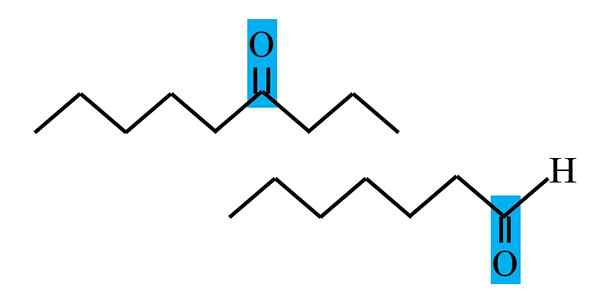 Diferensiasi keton dan aldehida dari formula struktural. Sumber: Gabriel Bolívar.
Diferensiasi keton dan aldehida dari formula struktural. Sumber: Gabriel Bolívar. Baik aldehida dan keton memiliki kesamaan dengan keberadaan kelompok karbonil. Sifat kimianya dan fisiknya adalah karena itu. Namun, lingkungan molekuler mereka tidak sama di kedua senyawa; Di yang pertama dia berada di posisi terminal, dan di detik, di mana saja dalam rantai.
Misalnya, pada gambar atas grup karbonil ada di dalam kotak kebiruan. Di keton, di sebelah kotak ini harus ada segmen karbon atau rantai lain (terbalik); Saat berada di aldehida, hanya ada atom hidrogen (di bawah).
Jika C = O berada di salah satu ujung rantai, itu akan menjadi aldehida; Itu adalah cara paling langsung untuk membedakannya dari cetona.
PENGENAL
Tetapi bagaimana mengetahui secara eksperimental jika senyawa yang tidak diketahui adalah aldehida atau keton? Ada banyak metode, dari spektroskopi (penyerapan radiasi inframerah, IR), atau tes kualitatif organik.
Mengenai esai kualitatif, ini didasarkan pada reaksi bahwa ketika memberikan positif analis akan mengamati respons fisik; Perubahan warna, pelepasan panas, pembentukan gelembung, dll.
Misalnya, tambahkan ke sampel larutan asam k2Cr2SALAH SATU7 Aldehida akan diubah menjadi asam karboksilat, yang membuat warna larutan berubah dari oranye menjadi hijau (uji positif). Sementara itu, keton tidak bereaksi, dan oleh karena itu, analis tidak mengamati perubahan warna apa pun (tes negatif).
Percobaan lain adalah menggunakan reagen Tollens, [AG (NH3)2]+, sehingga aldehida mengurangi kation ag+ ke logam perak. Dan hasilnya: pembentukan cermin perak di bagian bawah tabung reaksi tempat sampel ditempatkan.
Contoh utama
Akhirnya, serangkaian contoh senyawa karbonil akan terdaftar:
-Ch3COOH, asam asetat
-Hcooh, asam format
-Ch3Coch3, Propanona
-Ch3Coch2Ch3, 2-butanone
-C6H5Coch3, acetophenone
-Ch3Cho, Etanal
-Ch3Ch2Ch2Ch2Cho, Pentanal
-C6H5Cho, Benzaldehyde
-Ch3Conh2, acetamide
-Ch3Ch2Ch2Cooch3, Propil asetat
Sekarang, jika contoh senyawa dikutip yang hanya memiliki kelompok ini, daftarnya hampir tidak ada habisnya.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Reid Danielle. (2019). Grup Karbonil: Properti & Gambaran Umum. Belajar. Pulih dari: belajar.com
- Sharleen Agvateesiri. (5 Juni 2019). Grup Karbonil. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Wiki Kids Ltd. (2018). Senyawa karbonil. Pulih dari: sederhana.Sains
- Toppr. (S.F.). Nomenklatur dan Struktur Grup Karbonil. Pulih dari: toppr.com
- Clark J. (2015). Oksidasi aldehida dan keton. Pulih dari: chemguide.bersama.Inggris

