Struktur Kalsium Karbida (CAC2), Properti, Perolehan, Penggunaan

- 1686
- 108
- Jessie Harvey
Dia Kalsium karbida Ini adalah senyawa anorganik yang dibentuk oleh elemen kalsium (Ca) dan karbon (c) (C). Formula kimianya adalah CAC2. Itu adalah padatan yang bisa berwarna tidak berwarna hingga kekuningan atau keabu -abuan, dan bahkan hitam tergantung pada kotoran yang dikandungnya.
Salah satu reaksi kimianya yang paling penting dari CAC2 adalah orang yang terjadi dengan air h2Atau, di mana bentuk asetilena hcuaranch. Oleh karena itu digunakan untuk mendapatkan asetilena secara industri. Karena reaksi air yang sama digunakan untuk buah dewasa, dalam meriam palsu dan dalam suar angkatan laut.
 CAC Calcium carbide2 padat. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons.
CAC Calcium carbide2 padat. Domain Ondřej Mangl / Pub. Sumber: Wikimedia Commons. Reaksi CAC2 Dengan air juga menghasilkan lumpur yang berguna untuk menyiapkan klinker (komponen semen), yang menghasilkan lebih sedikit karbon dioksida (CO2) Jika dibandingkan dengan metode tradisional memproduksi semen.
Dengan nitrogen (n2) Kalsium karbida membentuk sianamida kalsium, yang digunakan sebagai pupuk. CAC2 Ini juga digunakan untuk menghilangkan belerang dari paduan logam tertentu.
Beberapa waktu yang lalu CAC2 Itu digunakan dalam lampu karbida yang disebut SO, tetapi ini tidak lagi sangat umum karena berbahaya.
[TOC]
Struktur
Kalsium karbida adalah senyawa ionik dan dibentuk oleh ion kalsio Ca2+ dan karbida atau asetiluro C22-. Ion karbida terdiri dari dua atom karbon yang disatukan oleh ikatan rangkap tiga.
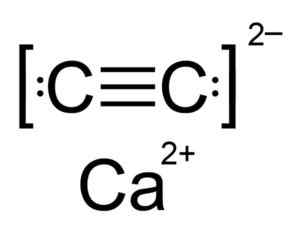 Struktur kimia kalsium karbida. Penulis: Hellbus. Sumber: Wikimedia Commons.
Struktur kimia kalsium karbida. Penulis: Hellbus. Sumber: Wikimedia Commons. Struktur kristal CAC2 Berasal dari kubik (seperti natrium klorida NaCl), tetapi seperti ion c22- Strukturnya memanjang terdistorsi dan berubah tetragonal.
Tata nama
- Kalsium karbida
- Kalsium karbida
- Kalsium asetilur
Properti
Keadaan fisik
Solid kristal yang saat murni tidak berwarna, tetapi jika terkontaminasi dengan senyawa lain itu bisa kekuningan atau keabu -abuan menjadi hitam.
 CAC Calcium carbide2 Dengan kotoran. Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
CAC Calcium carbide2 Dengan kotoran. Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Berat molekul
64.0992 g/mol
Itu dapat melayani Anda: Alilo: Unit Allyic, Carbocation, Radikal, ContohTitik lebur
2160 ºC
Titik didih
CAC2 mendidih pada 2300 ºC dengan dekomposisi. Titik didih harus diukur di bawah atmosfer inert, yaitu, tanpa oksigen atau kelembaban.
Kepadatan
2.22 g/cm3
Sifat kimia
Kalsium karbida bereaksi dengan air untuk membentuk hc.comch asetilena dan Ca kalsium hidroksida (OH)2:
CAC2 + 2 h2O → HCHCH + CA (OH)2
Asetilena mudah terbakar, oleh karena itu di hadapan kelembaban CAC2 Itu bisa mudah terbakar. Namun, saat kering tidak.
 CAC Calcium carbide2 Dengan bentuk air asetilena HCHCH, senyawa yang mudah terbakar. Kristina Kravets/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons.
CAC Calcium carbide2 Dengan bentuk air asetilena HCHCH, senyawa yang mudah terbakar. Kristina Kravets/CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons. Kalsium karbida bereaksi dengan nitrogen n2 Untuk membentuk sianamide CACN CALSIO2:
CAC2 + N2 → Cacn2 + C
Memperoleh
Kalsium karbida diproduksi secara industri dalam oven busur listrik berdasarkan campuran kalsium karbonat (CACO3) dan batubara (c) yang diserahkan pada suhu 2000 ° C. Reaksi dirangkum sebagai berikut:
Maling3 + 3 C → CAC2 + Co ↑ + co2↑
Atau juga:
CAO + 3 C → CAC2 + Co ↑
Dalam oven busur listrik ada busur listrik antara dua elektroda grafit, yang menahan suhu tinggi yang terbentuk. Kalsium karbida dengan kemurnian 80-85% diperoleh.
Aplikasi
Dalam produksi asetilena
Secara industri, reaksi kalsium karbida dengan air untuk menghasilkan asetilena C digunakan2H2.
CAC2 + 2 h2O → HCHCH + CA (OH)2
Ini adalah penggunaan kalsium karbida terpenting. Di beberapa negara, asetilena sangat dihargai, karena memungkinkan untuk menghasilkan polivinil klorida, yang merupakan jenis plastik. Selain itu asetilena berfungsi untuk melakukan lasan pada suhu tinggi.
 Logam nyala asetilena hc.comChch pada suhu yang sangat tinggi. Penulis: ShutterBug75. Sumber: Pixabay.
Logam nyala asetilena hc.comChch pada suhu yang sangat tinggi. Penulis: ShutterBug75. Sumber: Pixabay. Dalam mengurangi emisi CO2
Sisa -sisa yang diperoleh dari mendapatkan asetilena mulai dari CAC2 (Juga disebut "lumpur kalsium karbida" atau "residu kalsium karbida") mereka berfungsi untuk digunakan dalam mendapatkan klinker atau beton.
Dapat melayani Anda: aplikasi teknologi emisi atom elektronikLumpur kalsium karbida memiliki kandungan kalsium hidroksida tinggi (CA (OH)2) (Sekitar 90%), beberapa kalsium karbonat (CACO3) dan memiliki pH lebih besar dari 12.
 Residu kalsium karbida dapat digunakan dalam aktivitas konstruksi untuk menyiapkan beton, sehingga mengurangi generasi CO2 dari industri tersebut. Penulis: Engin Akyurt. Sumber: Pixabay.
Residu kalsium karbida dapat digunakan dalam aktivitas konstruksi untuk menyiapkan beton, sehingga mengurangi generasi CO2 dari industri tersebut. Penulis: Engin Akyurt. Sumber: Pixabay. Untuk alasan ini Anda dapat bereaksi dengan Sio2 lisan2SALAH SATU3 membentuk produk yang mirip dengan yang diperoleh dengan proses hidrasi semen.
Salah satu aktivitas manusia yang menghasilkan ko -emisi terbanyak2 Ini adalah industri konstruksi. CO2 Itu dihasilkan di sebelah timur kalsium karbonat selama reaksi membentuk beton.
Menggunakan lumpur kalsium karbida untuk menggantikan kalsium karbonat (CACO3) Telah ditemukan bahwa ko -emisi berkurang2 Di 39%.
Dalam mendapatkan kalsium sianamida
Kalsium karbida juga digunakan secara industri untuk mendapatkan Cacn kalsium sianamida2.
CAC2 + N2 → Cacn2 + C
Kalsium sianamida telah digunakan sebagai pupuk, karena dengan air tanah menjadi sianamide H2N = c = n, yang menyediakan nitrogen untuk tanaman, nutrisi penting untuk ini.
Di industri metalurgi
Kalsium karbida digunakan untuk menghilangkan paduan seperti Ferroníquel. CAC beragam2 Dengan paduan cair pada 1550 ° C. Sulphur (S) bereaksi dengan kalsium karbida dan kalsium sulfida CAS dan batubara C:
CAC2 + S → 2 C + CAS
Penghapusan belerang disukai jika pencampuran efisien dan kandungan karbon dalam paduan rendah. Casclium kalsium sulfida mengapung di permukaan paduan cair di mana ia memilih dan dibuang.
Dalam beberapa kegunaan
Kalsium karbida telah digunakan dalam penghapusan belerang besi. Juga sebagai bahan bakar dalam produksi baja dan sebagai deoksidan yang kuat.
Dapat melayani Anda: substitusi elektrofilik aromatik: mekanisme dan contohItu digunakan untuk matang buah. Dari kalsium karbida dengan air, asetilena dihasilkan, yang menginduksi pematangan buah, seperti pisang.
 Pisang dapat matang menggunakan CAC Calcium carbide2. Penulis: Foto Alexas. Sumber: Pixabay.
Pisang dapat matang menggunakan CAC Calcium carbide2. Penulis: Foto Alexas. Sumber: Pixabay. Kalsium karbida digunakan dalam meriam palsu untuk menyebabkan kebisingan ledakan keras yang menjadi ciri mereka. Di sini juga digunakan pembentukan asetilena, yang meledak dengan percikan di dalam artefak.
CAC2 Ini digunakan untuk menghasilkan sinyal di laut lepas dalam suar angkatan laut yang mempertimbangkan diri sendiri.
Penggunaan yang dihentikan
CAC2 Itu telah digunakan dalam lampu karbida yang disebut SO. Pengoperasian ini terdiri dalam air menetes di kalsium karbida untuk membentuk asetilena, yang menyala dan dengan demikian memberikan cahaya.
Lampu ini digunakan di tambang batubara, tetapi penggunaannya dihentikan karena adanya metana gas cho4 Di tambang ini. Gas ini mudah terbakar dan nyala lampu karbida dapat membuatnya api atau dieksploitasi.
 Lampu kalsium karbida cac2. Domain scehardt / pub. Sumber: Wikimedia Commons.
Lampu kalsium karbida cac2. Domain scehardt / pub. Sumber: Wikimedia Commons. Mereka banyak digunakan di tambang batuan batu tulis, tembaga dan timah, dan juga di mobil pertama, sepeda motor dan sepeda, seperti lampu depan atau lampu depan.
Mereka saat ini telah digantikan oleh lampu listrik atau bahkan lampu LED. Namun, mereka masih digunakan di negara -negara seperti Bolivia, di tambang perak potosí.
Risiko
CAC Calcium carbide2 Kering tidak mudah terbakar tetapi dengan adanya kelembaban bentuk asetilena, yaitu.
Untuk memadamkan api di hadapan CAC2 Air, busa, karbon dioksida atau alat pemadam halogen tidak boleh digunakan. Natrium atau kalsium hidroksida harus digunakan.
Referensi
- Ropp, r.C. (2013). Grup 14 (C, SI, GE, SN, dan PB) Senyawa Bumi Alkali. Karbida kalsium. Dalam ensiklopedia senyawa bumi alkali. Pulih dari scientedirect.com.
- Pohaniish, r. P. (2017). C. Kalsium karbida. Dalam Buku Pegangan Sittig tentang bahan kimia dan carcinagens yang beracun dan berbahaya (edisi ketujuh). Pulih dari scientedirect.com.
- Matahari, h. et al. (2015). Sifat resue kalsium karbida kombinasi kimia dan perfilinya pada sifat semen. Bahan 2015, 8, 638-651. NCBI pulih.Nlm.Nih.Pemerintah.
- Nie, Z. (2016). Penilaian Eko-Material dan Siklus Hidup. Studi Kasus: CO2 Analisis emisi klinker lumpur kalsium karbida. Dalam pembuatan bahan canggih hijau dan berkelanjutan. Pulih dari scientedirect.com.
- Crundwell, f.K. Et al. (2011). Menyempurnakan ferronickel cair. Pelepasan belerang. Dalam metalurgi ekstraktif logam nikel, kobalt dan kelompok platinum. Pulih dari scientedirect.com.
- Tressler, r.DAN. (2001). Keramik Struktural dan Thermostruktural. Karbida. Di Encyclopedia of Material Science and Technology. Pulih dari scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.

