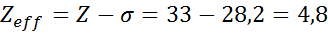Beban nuklir yang efektif
- 1144
- 84
- Miss Wm Hudson
Apa itu beban nuklir yang efektif?
Itu beban nuklir yang efektif (diwakili sebagai zEff Dan dalam beberapa kasus seperti z*) Ini adalah beban nuklir bersih yang dialami sebuah elektron saat berada dalam atom polyhelectronic (yaitu, ia memiliki lebih dari satu elektron).
Dengan cara yang lebih tepat, itu adalah muatan listrik yang akan memiliki inti dari atom hipotetis yang mampu menarik satu -satunya elektron dengan gaya yang sama dengan mana inti atom asli menarik elektron yang sama di hadapan semua elektron lainnya.
Ini adalah beban nuklir yang dikoreksi yang memperhitungkan efek keberadaan elektron lain pada atom polylectronic. Beban yang dikurangi ini menjelaskan mengapa elektron terluar dalam atom polyhelectronic terkait dengan lebih lemah dengan nukleus daripada elektron internal.
Beban nuklir yang efektif adalah konsep yang sangat penting dalam kimia, karena memungkinkan kita untuk memahami kecenderungan periodik dari banyak sifat seperti jari -jari atom, jari -jari ion, elektronegativitas, energi ionisasi dan banyak lagi.
Mengapa beban nuklir yang efektif ada?
Beban nuklir yang efektif muncul dari dua fenomena:
- Efek pelindung elektron pada atom polyhelectronic.
- Penolakan elektrostatik di antara elektron karena setiap orang memiliki muatan listrik yang sama.
Dia efek perisai Ini terdiri dari semacam perisai yang dibentuk oleh elektron internal atom yang menutupi nukleus. Ini membuat elektron terluar "merasakan" daya tarik yang lebih rendah pada bagian nukleus daripada yang mereka rasakan jika elektron lain tidak ada.
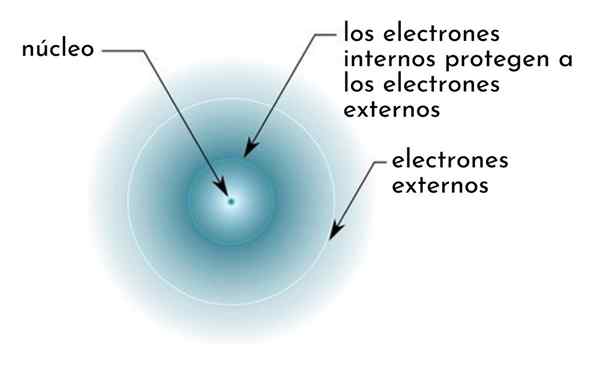 Gambar secara skematis menunjukkan elektron internal yang bertindak sebagai layar yang melindungi elektron eksternal dari daya tarik nukleus
Gambar secara skematis menunjukkan elektron internal yang bertindak sebagai layar yang melindungi elektron eksternal dari daya tarik nukleus Sebagai contoh, beban nuklir atom natrium adalah +11 (angka atomnya adalah z = 11), tetapi, satu -satunya elektron valencia yang dimiliki, sebenarnya merasakan gaya tarik beban hanya +2,2.
Dapat melayani Anda: natrium benzoat: struktur, sifat, penggunaan dan risikoDengan kata lain, pelindung 10 elektron internal lainnya menyebabkan elektron valencia natrium merasakan gaya tarik nuklir hanya kelima dari apa yang seharusnya.
Selain efek perisai, Penolakan antar elektron (yang memiliki muatan listrik yang sama) juga berkontribusi untuk menangkal kapasitas inti untuk menarik elektron eksternal. Artinya, tolakan ini juga membantu mengurangi beban nuklir yang efektif.
Karakteristik penting dari beban nuklir yang efektif
Perlu dicatat bahwa efek pelindung yang bertanggung jawab untuk mengurangi beban nuklir yang efektif hanya mempengaruhi elektron yang berada dalam tingkat energi yang sama atau di lapisan atas, tetapi bukan elektron paling internal yang paling internal. Selain itu, efeknya tidak sama untuk elektron yang ditemukan dalam orbital atom S dan P daripada yang ditemukan di orbital D dan F.
Untuk alasan ini, setiap set elektron dari setiap lapisan atau tingkat energi terasa beban nuklir efektif yang berbeda. Ini memiliki implikasi penting mengenai sifat kimia dari berbagai elemen.
Tren berkala dari beban nuklir yang efektif
Selama periode
Elektron yang terletak pada tingkat energi yang sama lebih sedikit perisai daripada yang ditemukan di tingkat energi yang lebih rendah.
Karena itu, efek perisai tidak meningkat pesat saat kita bergerak selama suatu periode, tetapi beban nuklir yang sebenarnya. Karena alasan ini, beban nuklir yang efektif meningkat dari kiri ke kanan di tabel periodik.
Sepanjang grup
Di sisi lain, ketika melewati dari satu periode ke periode lain dalam kelompok yang sama (yaitu, ketika kita bergerak ke bawah di sepanjang kelompok), seluruh lapisan elektron internal yang sangat pelindung ditambahkan. Ini membuat beban nuklir yang efektif berkurang dari atas ke bawah atau, apa yang sama, meningkat dari bawah ke atas.
Dapat melayani Anda: AyaroínaFormula beban nuklir yang efektif
Beban nuklir yang efektif dapat dihitung dengan menggunakan persamaan semi -time yang sangat sederhana yang memperhitungkan nilai aktual dari beban nuklir (diberikan oleh nomor atom, z) dan istilah yang disebut pelindung konstan konstan. Yang terakhir mencakup efek dari keberadaan elektron lain dalam satu.
Persamaan diberikan oleh:
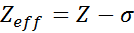
di mana z adalah angka atom dan σ (Sigma huruf Yunani) mewakili konstanta pelindung, yang tergantung pada konfigurasi elektronik.
Aturan Slater
Konstanta perisai dapat diperkirakan dari sistem yang dikenal sebagai aturan Slater. Aturan -aturan ini memungkinkan menghitung konstanta perisai elektron dengan menambahkan kontribusi elektron lain untuk konstanta perisai tersebut. Aturan -aturan ini dapat diringkas sebagai berikut:
- Elektron apa pun yang berada pada tingkat energi yang sama (level n0) Memberikan jumlah 0,35 untuk konstanta pelindung, kecuali keduanya berada di level 1, dalam hal ini menyediakan 0,30.
- Setiap elektron yang berada di level sebelumnya (pada level n0-1) dalam orbital S atau P, ia membawa 0,85; Di sisi lain, jika ada dalam orbital d atau f itu berkontribusi 1.
- Semua elektron lain yang berada pada tingkat energi yang lebih rendah (n0-2, n0-3, dll.), berkontribusi 1 ke konstanta perisai.
Contoh perhitungan beban nuklir yang efektif
Elektron valencia dari atom natrium
Konfigurasi elektronik atom natrium adalah 1s22s22 p63S1. Artinya jika kita ingin menghitung beban nuklir efektif yang dirasakan oleh elektron valencia (elektron 3s1), kita harus menambahkan kontribusi 10 elektron lainnya mengikuti aturan Slater.
Dapat melayani Anda: besi oksida (ii): struktur, nomenklatur, sifat, penggunaanBagaimana kita menghitung konstanta perisai elektron 3S1 (N0= 3) Dan ini sendirian di lapisan Valencia, tidak ada elektron lain pada tingkat energi yang sama.
Level segera sebelumnya adalah n0-1 = 2, di mana ada 8 elektron dalam orbital S atau P yang masing -masing berkontribusi 0,85, dan tidak ada elektron dalam orbital D atau F.
Akhirnya, satu -satunya level lebih rendah dari 2 adalah n = 1, di mana hanya ada 2 elektron. Semua ini dirangkum dalam tabel berikut:
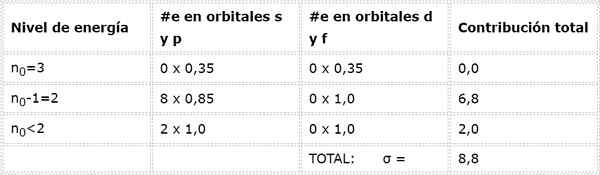
Seperti yang dapat dilihat, elektron internal natrium memberikan konstanta perisai 8,8, sehingga beban nuklir efektif yang rasakan elektron 3S1 adalah:
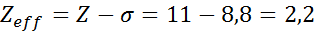
Elektron Arsenik Valencia
Konfigurasi elektronik arsenik adalah 1s22s22 p63S23p63d104s24p3. Lapisan Valencia adalah lapisan 4 (n0= 4) Itu memiliki 5 elektron: (4s24p3). Dalam hal ini, masing -masing dari 5 elektron ini akan merasakan efek dari 4 lainnya yang berada di lapisan yang sama dan dari 28 elektron internal lainnya seperti yang ditunjukkan pada tabel:
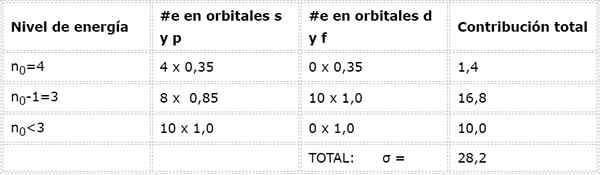
Oleh karena itu, beban nuklir efektif yang dirasakan elektron valencia arsenik adalah: