Melatih kation, perbedaan dengan anion dan contoh

- 2071
- 468
- Tommie Smith
A kation Ini adalah spesies kimia yang memiliki muatan positif. Dua jenis ion yang ada adalah untuk anion. Bebannya adalah produk dari defisiensi elektron dalam atom, yang menyebabkan proton inti melakukan daya tarik yang lebih besar. Untuk setiap elektron yang kehilangan atom netral, beban positif meningkat dalam suatu unit.
Jika atom kehilangan elektron, dan oleh karena itu, jumlah proton lebih besar dari satu, maka beban positifnya akan +1; Jika Anda kehilangan dua elektron, bebannya akan +2, dan seterusnya. Ketika kation memiliki beban +1, dikatakan monovalen; Di sisi lain, jika beban tersebut lebih besar dari +1, dikatakan bahwa kation serbaguna.
 Ion hidroni, salah satu kation kation paling sederhana. Sumber: Gabriel Bolívar.
Ion hidroni, salah satu kation kation paling sederhana. Sumber: Gabriel Bolívar. Di gambar atas ditunjukkan ke kation h3SALAH SATU+, Disebut ion Hydronio. Seperti yang dapat dilihat, hampir tidak memiliki beban +1, sesuai dengan kation monovalen.
Kation adalah spesies penting, karena mereka mengerahkan kekuatan elektrostatik dengan lingkungannya dan molekul di sekitar. Mereka memiliki interaksi tinggi dengan air, cairan yang menghidrasi dan mengangkutnya di tanah basah, dan kemudian mencapai akar tanaman dan digunakan untuk fungsi fisiologisnya.
[TOC]
Bagaimana kation terbentuk?
Disebutkan bahwa ketika sebuah atom kehilangan elektron, jumlah proton terbesarnya, dalam kaitannya dengan elektron, memberikan gaya tarik yang diterjemahkan menjadi beban positif. Tapi bagaimana kerugian elektron bisa terjadi? Jawabannya tergantung pada transformasi yang terjadi dalam reaksi kimia.
Perlu dicatat bahwa keberadaan atom dengan beban positif tidak selalu menyiratkan pembentukan kation. Sehingga dapat dipertimbangkan, seharusnya tidak ada atom dengan beban formal negatif yang menetralisir. Kalau tidak, akan ada ketertarikan dan tolakan dalam senyawa yang sama dan akan netral.
Dapat melayani Anda: kalsium sulfat (case4): struktur kimia, sifat, penggunaanBiaya formal dan lebih banyak tautan
Atom elektronegatif menarik elektron ikatan kovalen mereka ke arah mereka. Meskipun elektron dibagi secara merata, ada titik di mana mereka sebagian akan memiliki lebih sedikit elektron daripada dalam konfigurasi basal mereka; Ini adalah, atom bebas mereka tanpa dikaitkan dengan elemen lain.
Kemudian, atom -atom elektronegatif ini akan mulai mengalami kekurangan elektron, dan dengan itu, proton inti mereka akan mengerahkan kekuatan ketertarikan yang lebih besar; Beban formal positif lahir. Jika hanya ada beban formal positif, senyawa akan memanifestasikan beban ionik positif global; Dengan demikian kation lahir.
Atom oksigen kation h3SALAH SATU+ Itu adalah contoh yang setia dari hal di atas. Dengan memiliki tiga ikatan O-H, satu lebih dari dalam molekul air (H-O-H), mengalami hilangnya elektron sehubungan dengan keadaan basalnya. Perhitungan beban formal memungkinkan untuk menentukan kapan ini terjadi.
Jika pembentukan O-H lain diasumsikan untuk satu saat, kation divalen akan diperoleh4SALAH SATU2+. Perhatikan bahwa beban divalen di atas kation ditulis sebagai berikut: angka mengikuti simbol '+'; Dengan cara yang sama, anion dilanjutkan.
Oksidasi
Logam adalah performator kation par excellence. Namun, tidak semua orang dapat membentuk ikatan kovalen (atau setidaknya murni kovalen). Sebaliknya, mereka kehilangan elektron untuk membangun ikatan ionik: beban positif menarik negatif, disatukan oleh kekuatan fisik.
Oleh karena itu, logam kehilangan elektron untuk berpindah dari m ke mN+, Di mana N Biasanya sama dengan jumlah grup Anda dalam tabel periodik; meskipun N Anda dapat mengambil beberapa nilai keseluruhan, yang terjadi terutama dengan logam transisi. Hilangnya elektron ini dilakukan dalam jenis reaksi kimia yang disebut oksidasi.
Dapat melayani Anda: alkohol tersier: struktur, sifat, contohLogam mengoksidasi, kehilangan elektron, jumlah proton atomnya melebihi elektron, dan akibatnya menunjukkan beban positif. Agar ada oksidasi, harus ada zat pengoksidasi, yang mengurangi atau mendapatkan elektron yang hilang oleh logam. Oksigen adalah agen pengoksidasi paling terkenal dari semuanya.
Perbedaan dengan anion
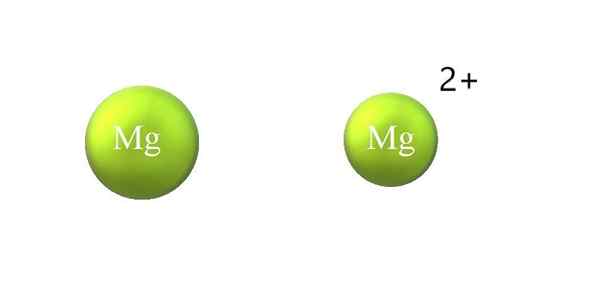 Kontraksi radius atom dalam kation. Sumber: Gabriel Bolívar.
Kontraksi radius atom dalam kation. Sumber: Gabriel Bolívar. Di bawah ini adalah perbedaan antara kation dan anion:
-Kation umum lebih kecil dari anion. Gambar atas menunjukkan bagaimana jari -jari atom Mg dikurangi dengan kehilangan dua elektron dan menjadi kation mg2+; Yang sebaliknya terjadi dengan anion: mereka menjadi lebih besar.
-Ini memiliki lebih banyak proton daripada elektron, sedangkan anion memiliki lebih banyak elektron daripada proton.
-Menjadi lebih kecil, kepadatan bebannya lebih tinggi, dan karenanya memiliki kekuatan polarisasi yang lebih besar; yaitu, merusak awan elektronik atom tetangga.
-Kation bergerak ke arah yang sama dengan medan listrik yang diterapkan, sedangkan anion melakukannya dalam arah yang berlawanan.
Contoh kation yang paling umum
Monoatomik
Kation monoatomik sebagian besar berasal dari logam (kecuali untuk pengecualian tertentu, seperti h+). Dari yang lain, sangat jarang untuk mempertimbangkan kation yang berasal dari elemen non -metalik.
Akan terlihat bahwa banyak dari mereka di atau serbaguna, dan bahwa besarnya beban mereka setuju dengan jumlah kelompok mereka di tabel periodik.
Itu dapat melayani Anda: ribulosa-1,5-biphosphate (rubp): karakteristik, karbolixation-Li+
-Na+
-K+
-RB+
-CS+
-Fr+
-Ag+
Semua memiliki kesamaan beban '1+', yang ditulis tanpa menempatkan angka, dan juga berasal dari Grup 1: Alkali Logam. Selain itu, ada AG kation+, Salah satu logam transisi yang paling umum.
-Menjadi2+
-Mg2+
-Ac2+
-Tn2+
-Ba2+
-Ra2+
Kation divalen ini berasal dari logam masing -masing milik kelompok 2: logam alkaliinor.
-Ke3+
-Ga3+
-Di dalam3+
-Tl3+
-NH3+
Kation trivalen dari kelompok boro.
Sejauh ini contoh -contoh telah ditandai dengan memiliki valensi atau pemuatan tunggal. Kation lain menunjukkan lebih dari satu valensi atau keadaan oksidasi positif:
-Sn2+
-Sn4+ (timah)
-Bersama2+
-Bersama3+ (kobalt)
-Au+
-Au3+ (emas)
-Keyakinan2+
-Keyakinan3+ (besi)
Dan logam lain, seperti mangan, masih dapat memiliki lebih banyak valensi:
-M N2+
-M N3+
-M N4+
-M N7+
Semakin besar beban, lebih kecil dan polarisasi akan menjadi kation.
Poliatomik
Tanpa masuk ke kimia organik, ada kation anorganik dan polylamical yang sangat umum dalam kehidupan sehari -hari; seperti:
-H3SALAH SATU+ (Hydronio, sudah disebutkan).
-NH4+ (amonium).
-TIDAK2+ (Nitronio, hadir dalam proses nitrasi).
-Ph4+ (Fosfonium).
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Helmestine, Anne Marie, PH.D. (5 Mei 2019). Definisi dan contoh kation. Pulih dari: thinkco.com
- Wyman Elizabeth. (2019). Kation: Definisi & Contoh. Belajar. Pulih dari: belajar.com
- Boneka. (2019). Ins positif dan negatif: kation dan anion. Pulih dari: boneka.com
- Wikipedia. (2019). Kation. Pulih dari: is.Wikipedia.org
- « Struktur anisol, sifat, nomenklatur, risiko dan penggunaan
- Asal usul arkeolitik, karakteristik, iklim, flora dan fauna »

