Struktur anisol, sifat, nomenklatur, risiko dan penggunaan
- 2410
- 554
- Dewey Runolfsdottir
Dia anisol atau metoxibenzene Ini adalah senyawa organik yang terdiri dari eter aromatik yang formula kimianya c6H5Och3. Kondisi fisiknya adalah cairan yang tidak berwarna, yang dapat menghadirkan warna kuning. Itu mudah dikenali oleh aroma adasnya yang khas.
Ini kemudian merupakan senyawa yang mudah menguap dan gaya kohesi yang tidak terlalu tinggi; Karakteristik biasa dalam eter ringan, yang disimpan dalam wadah kecil tertutup. Secara khusus, anisol adalah yang paling sederhana dari alkil auril eter; yaitu, yang memiliki komponen aromatik (AR) dan alkil lainnya (r), ar-o-r.
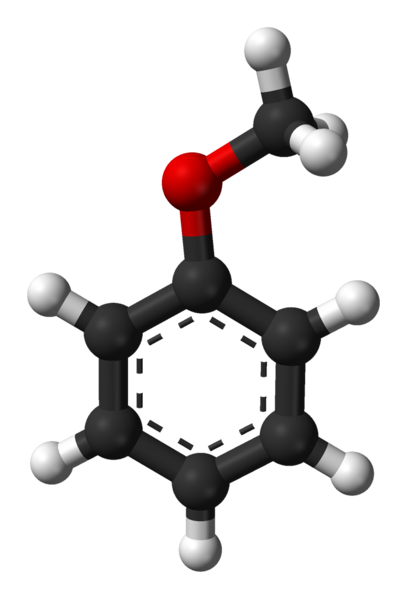
 Molekul anisol. Sumber: Ben Mills via Wikipedia.
Molekul anisol. Sumber: Ben Mills via Wikipedia. Grup c6H5- datang untuk menunjukkan ar, dan -ch3 A r, dengan demikian memiliki c6H5-O-ch3. Cincin aromatik, dan keberadaan -och3 Sebagai kelompok substituen yang disebut Metoxi, anisol memberikan nukleofilisitas lebih unggul daripada benzena dan nitrobenzena. Oleh karena itu, ini berfungsi sebagai molekul perantara untuk sintesis senyawa dengan aktivitas farmakologis.
Aroma adasnya yang khas telah digunakan untuk menambahkan anisol ke produk kosmetik dan kebersihan yang menuntut aroma yang menyenangkan.
[TOC]
Struktur anisol
Pada gambar atas struktur molekul anisol ditunjukkan dengan menggunakan model bola dan batang. Cincin aromatik dihargai, yang karbonnya SP2 dan karena itu datar, sebagai lembaran heksagonal; Dan terkait dengannya, adalah kelompok Metoxi, yang karbonnya adalah SP3, dan hidrogennya di atas atau di bawah bidang cincin.
Pentingnya kelompok -och3 Dalam struktur itu melampaui batasan dengan geometri datar molekul: memberikannya polaritas, dan akibatnya, molekul apolar benzena memperoleh momen dipol permanen.
Momen dipolar
Momen dipol ini disebabkan oleh atom oksigen, yang menarik kepadatan elektronik dari cincin aromatik dan metil. Berkat ini, molekul Anisol dapat berinteraksi dengan pasukan setengah dipolo; Meskipun, tidak ada kemungkinan untuk membentuk jembatan hidrogen, karena itu adalah eter (ROR tidak memiliki oksigen terkait).
Dapat melayani Anda: natrium klorida (NaCl)Titik didihnya yang tinggi (154ºC), secara eksperimental mensertifikasi interaksi antarmolekul yang kuat yang mengatur cairannya. Demikian juga, kekuatan dispersi London hadir, tergantung pada massa molekul, dan interaksi π -π antara cincin itu sendiri.
Kristal
Struktur Anisol, bagaimanapun, tidak mengizinkannya.F = -37ºC). Ini mungkin juga disebabkan oleh fakta bahwa ketika jarak antarmolekul berkurang, tolakan elektrostatik antara cincin aromatik tetangga sangat kuat.
Oleh karena itu, dan menurut studi kristalografi, molekul anisol dalam kristal pada suhu -173ºC tidak dapat dipesan sedemikian rupa sehingga cincin mereka dihadapi; Artinya, pusat aromatiknya tidak selaras satu sama lain, tetapi kelompok -och3 Itu naik atau di bawah cincin tetangga.
Properti
Penampilan fisik
Cairan tidak berwarna tetapi itu bisa menghadirkan nada jerami berwarna ringan.
Bau
Baunya sedikit mirip dengan biji adas manis.
Rasa
Manis; Namun, ini cukup beracun, jadi tes ini berbahaya.
Massa molekul
108.140 g/mol.
Kepadatan
0.995 g/ml.
Kepadatan uap
3.72 (dalam hubungan udara = 1).
Titik lebur
-37ºC.
Titik didih
154ºC.
titik pengapian
125ºC (cangkir terbuka).
Suhu self -rection
475ºC.
Zat yang lengket dan kental
0,778 cp pada 30ºC.
Tegangan permukaan
34.15 Dins/cm A 30ºC.
Indica refraksi
1.5179 hingga 20ºC.
Kelarutan
Tidak larut dalam air (sekitar 1mg/ml). Dalam pelarut lain, seperti aseton, eter dan alkohol, tetap saja sangat larut.
Nukleofilisitas
Cincin aromatik Anisol kaya akan elektron. Ini karena oksigen, meskipun merupakan atom yang sangat elektronegatif, berkontribusi dengan elektron awan π mereka untuk mendemokasikannya melalui cincin dalam berbagai struktur resonansi. Akibatnya, lebih banyak elektron menempuh sistem aromatik dan karenanya meningkatkan nukleofilisitasnya.
Itu dapat melayani Anda: alkohol camphorous: struktur, formula, sifat dan penggunaanSecara eksperimental peningkatan nukleofilisitas telah ditunjukkan dengan membandingkan reaktivitasnya, dalam menghadapi substitusi elektrofilik aromatik, dengan benzena, dengan benzena, dengan benzena, dengan benzena. Dengan demikian, efek luar biasa dari kelompok -och dibuktikan3 Pada sifat kimia senyawa.
Perlu juga dicatat bahwa substitusi elektrofilik terjadi pada posisi yang berdekatan (-orto) dan berlawanan (-untuk) dengan kelompok metoxi; yaitu, ini adalah direktur orto-for.
Reaktivitas
Nukleofilis Ring Aromatik Anisol sudah memungkinkan Anda untuk melihat bagaimana reaktivitasnya. Substitusi dapat terjadi baik di atas ring (disukai oleh nukleofilisitasnya), atau pada kelompok Metaxi yang sama; Di yang terakhir, tautan O-Ch rusak3 Untuk mengganti -ch3 oleh kelompok alquilis lain: o-alquilación.
Oleh karena itu, dalam proses alkilasi, anisol dapat menerima grup R (fragmen molekul lain) menggantikan h cincinnya (c-hiving), atau mengganti ch3 Dari grup Metoxi Anda. Gambar berikut menggambarkan apa yang baru saja dikatakan:
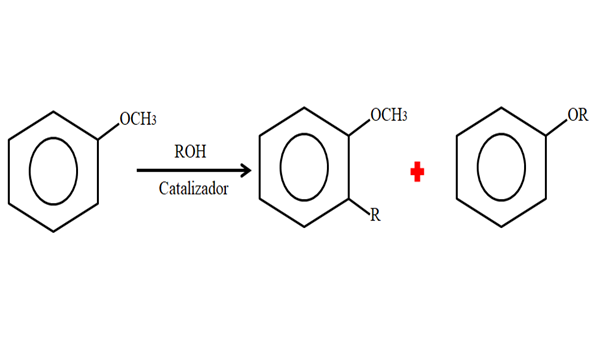 Alkilasi anisol. Sumber: Gabriel Bolívar.
Alkilasi anisol. Sumber: Gabriel Bolívar. Pada gambar grup R terletak di posisi -orto, tetapi juga bisa berada di posisi -untuk, berlawanan dengan -och3. Ketika o -alquilación terjadi, eter baru dengan kelompok lain -atau diperoleh.
Tata nama
Nama 'Anisol' adalah yang paling terkenal dan diterima, kemungkinan besar berasal dari baunya yang mirip dengan adas manis. Namun, nama 'metoxibenzene' cukup spesifik, karena menetapkan begitu struktur dan identitas eter aromatik ini; Ini adalah nama yang diatur oleh nomenklatur sistematis.
Nama lain yang kurang digunakan, tetapi sama -sama valid, adalah 'fenil metil eter', yang diatur oleh nomenklatur tradisional. Ini mungkin nama yang paling spesifik dari semuanya, karena secara langsung menunjukkan mana yang merupakan dua bagian struktural dari eter: phoenyl-o-metil, c6H5-O-ch3.
Risiko
Studi medis belum dapat menunjukkan kemungkinan efek fana anisol pada tubuh pada dosis rendah. Namun, seperti hampir semua zat kimia, ia menghasilkan iritasi ketika terlalu banyak waktu terpapar dan dalam konsentrasi sedang pada kulit, tenggorokan, paru -paru dan mata.
Dapat melayani Anda: hukum amagat: penjelasan, contoh, latihanJuga, karena nukleofilisitas cincinnya, sebagian darinya dimetabolisme dan karenanya dapat terbiodegradasi. Faktanya, sebagai akibat dari properti ini, simulasi menunjukkan bahwa ia gagal berkonsentrasi pada ekosistem air karena organismenya pertama kali menurunkannya; Dan karena itu, sungai, danau atau laut dapat mengumpulkan anisol.
Di tanah, mengingat volatilitasnya, ia menguap dengan cepat dan diseret oleh arus udara; Dengan demikian, massa atau perkebunan sayuran juga tidak banyak mempengaruhi.
Di sisi lain, secara atmosfer bereaksi dengan radikal bebas, dan karenanya tidak mewakili risiko polusi udara yang kami hirup.
Aplikasi
Sintesis organik
Dari anisol turunan lain dapat diperoleh dengan substitusi elektrofilik aromatik. Hal ini memungkinkan untuk digunakan sebagai perantara untuk sintesis obat, pestisida dan pelarut, yang ingin menambahkan karakteristik mereka. Rute sintetis sebagian besar terdiri dari.
Wewangian
Selain penggunaannya untuk sintesis organik, itu dapat digunakan secara langsung sebagai aditif untuk krim, salep dan parfum, memasukkan anti wewangian ke dalam produk tersebut.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. KE. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Pusat Nasional Informasi Bioteknologi. (2019). Anisole. Database PubChem, CID = 7519. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2019). Anisole. Diperoleh dari: di.Wikipedia.org
- Pereira, Cynthia C. M., De La Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Faselasi cair anisol dan fenol dikatalisis oleh niobium fosfat. Jurnal Masyarakat Kimia Brasil, 21 (2), 367-370. Dx.doi.org/10.1590/S0103-50532010000200025
- Seidel r. W. dan Goddard R. (2015). Anisole pada 100 K: Penentuan Struktur Kristal Pertama. Crystallogry C Struct Chem Act. Agustus; 71 (PT 8): 664-6. Doi: 10.1107/S2053229615012553
- Formulasi Kimia. (2018). Metoxibenzene. Pulih dari: formulasi quimica.com

