Sel elektrokimia

- 4183
- 1018
- Domingo Gutkowski
Apa itu sel elektrokimia?
Itu sel elektrokimia Mereka adalah perangkat di mana reaksi kimia berlalu di mana energi kimia diubah menjadi listrik atau sebaliknya. Sel -sel ini membentuk jantung elektrokimia, jiwa menjadi pertukaran potensial elektron yang dapat terjadi, spontan atau tidak secara spontan, antara dua spesies kimia.
Salah satu dari dua spesies teroksidasi, kehilangan elektron, sedangkan yang lainnya dikurangi dengan memenangkan elektron yang diserahkan. Umumnya spesies yang dikurangi adalah kation logam dalam larutan, yang dengan mendapatkan akhirnya secara elektrik menjadi elektroda yang terbuat dari logam yang sama. Di sisi lain, spesies yang mengoksidasi adalah logam, menjadi kation logam.
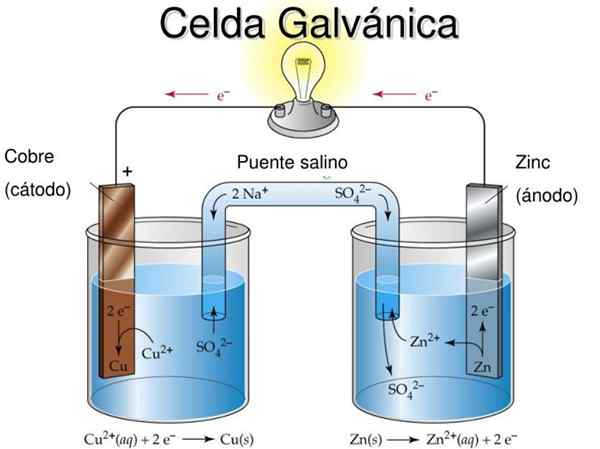
 Diagram sel elektrokimia Daniel. Sumber: Rechua [cc by (https: // createveCommons.Org/lisensi/oleh/3.0)]
Diagram sel elektrokimia Daniel. Sumber: Rechua [cc by (https: // createveCommons.Org/lisensi/oleh/3.0)] Misalnya, gambar superior mewakili sel Daniel: yang paling sederhana dari semua sel elektrokimia. Elektroda seng logam teroksidasi, melepaskan kation zn2+ ke lingkungan yang berair. Ini terjadi di wadah ZNSO4 dari kiri.
Di sebelah kanan, solusi yang mengandung CUO4 Itu berkurang, mengubah kation cu2+ Dalam tembaga logam yang disimpan pada elektroda tembaga. Selama pengembangan reaksi ini, elektron melakukan perjalanan sirkuit eksternal yang mengaktifkan mekanisme mereka; Dan karena itu, menyediakan listrik untuk pengoperasian peralatan.
Komponen sel elektrokimia
Elektroda
Dalam sel elektrokimia dihasilkan atau dikonsumsi. Untuk memastikan aliran elektron yang tepat harus ada bahan yang merupakan konduktor listrik yang baik. Di sinilah elektroda dan sirkuit eksternal datang, asalkan kabel tembaga, perak atau emas.
Elektroda adalah bahan yang menyediakan permukaan di mana reaksi dalam sel elektrokimia akan dikembangkan. Ada dua jenis sesuai dengan reaksi yang terjadi di dalamnya:
- Anoda, elektroda di mana oksidasi terjadi.
- Katoda, elektroda di mana reduksi terjadi.
Elektroda dapat dibuat dari bahan yang bereaksi, seperti dalam kasus sel Daniel (seng dan tembaga); atau, dari bahan lembam, seperti halnya ketika mereka terbuat dari platinum atau grafit.
Elektron yang ditetapkan oleh anoda harus mencapai katoda; Tetapi tidak melalui solusi, tetapi bepergian kabel logam yang bergabung dengan kedua elektroda ke sirkuit eksternal.
Pembubaran Elektrolit
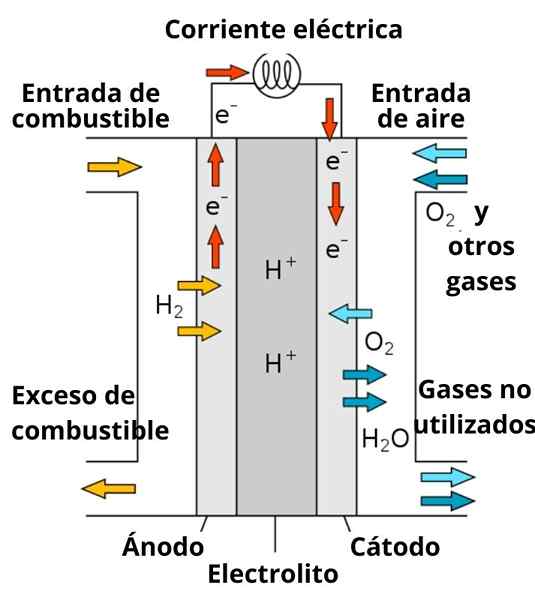 Skema Baterai Bahan Bakar Konduktif Proton
Skema Baterai Bahan Bakar Konduktif Proton Pembubaran yang mengelilingi elektroda juga memainkan peran penting, karena diperkaya dengan elektrolit yang kuat; seperti: kcl, kno3, NaCl, dll. Ion -ion ini mendukung migrasi elektron dari anoda ke katoda, serta konduksi mereka oleh sekitar elektroda untuk berinteraksi dengan spesies untuk mengurangi.
Air laut, misalnya, mengarah ke listrik yang jauh lebih baik daripada air suling, dengan konsentrasi ion yang lebih rendah. Itulah sebabnya sel elektrokimia memiliki solusi elektrolit yang kuat di antara komponen mereka.
Jembatan Saline
Ion solusi mulai mengelilingi elektroda yang menyebabkan polarisasi beban. Pembubaran di sekitar katoda mulai mengisi secara negatif, karena kation dikurangi; Dalam kasus sel Daniel, kation Cu2+ Dengan menyetor sebagai tembaga logam di katoda. Dengan demikian, ada defisit tuduhan positif.
Di sinilah jembatan saline campur tangan untuk menyeimbangkan beban dan mencegah elektroda terpolarisasi. Ke samping atau kompartemen kation katoda jembatan saline akan bermigrasi, baik k+ atau zn2+, Untuk menggantikan Cu2+ dikonsumsi. Sementara itu, dari jembatan saline tidak akan bermigrasi anion3- Menuju kompartemen anoda, untuk menetralkan konsentrasi kation Zn yang meningkat2+.
Itu dapat melayani Anda: kalium dikromat: rumus, sifat, risiko dan penggunaanJembatan saline terdiri dari larutan garam jenuh, dengan ujungnya ditutupi oleh gel ion permeabel, tetapi tahan air untuk air.
Jenis sel elektrokimia dan cara kerjanya
Cara sel elektrokimia bekerja tergantung pada jenisnya. Ada dua jenis fundamental: galvanik (atau volta) dan elektrolit
Galvanik
Sel Daniel adalah contoh dari sel elektrokimia galvanik. Di dalamnya reaksi terjadi secara spontan dan potensi baterai positif; Semakin besar potensinya, semakin besar listrik yang akan memasok sel.
Baterai atau baterai justru sel galvanik: potensi kimia antara kedua elektroda diubah menjadi energi listrik ketika sirkuit eksternal mengintervensi yang menghubungkannya. Dengan demikian, elektron bermigrasi dari anoda, menyalakan peralatan tempat baterai terhubung, dan dikembalikan langsung ke katoda.
Elektrolitik
Sel -sel elektrolitik adalah mereka yang reaksinya tidak terjadi secara spontan, kecuali mereka dipasok oleh energi listrik dari sumber eksternal. Di sini fenomena yang berlawanan terjadi: listrik memungkinkan reaksi kimia yang tidak spontan untuk berkembang.
Salah satu reaksi paling terkenal dan berharga yang terjadi dalam jenis sel ini adalah elektrolisis.
Baterai yang dapat diisi ulang adalah contoh elektrolit dan pada saat yang sama galvanik: mereka diisi ulang untuk membalikkan reaksi kimianya dan membangun kembali kondisi awal untuk menggunakan kembali lagi.
Contoh
Sel Daniel
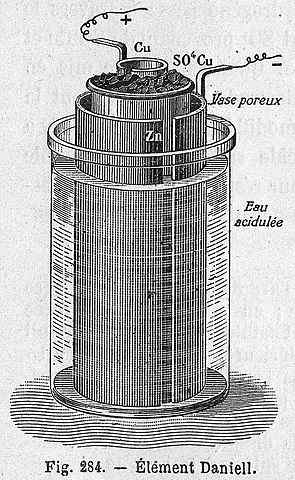 Skema Sel Daniel
Skema Sel Daniel Persamaan kimia berikut sesuai dengan reaksi sel Daniel di mana seng dan tembaga berpartisipasi:
Dapat melayani Anda: sewa halogenuros: properti, mendapatkan, contohZn (s) + cu2+(aq) → zn2+(aq) + cu (s)
Tapi Cu Cation2+ dan zn2+ Mereka tidak sendirian tetapi disertai dengan anion42-. Sel ini dapat direpresentasikan sebagai berikut:
Zn | Znso4 | | Cuso4 | Cu
Sel Daniel dapat dibangun di laboratorium apa pun, sangat berulang sebagai praktik dalam pengenalan elektrokimia. Sebagai cu2+ Itu disimpan sebagai cu, warna biru dari larutan cuso4 Itu akan hilang.
Sel platinum dan hidrogen
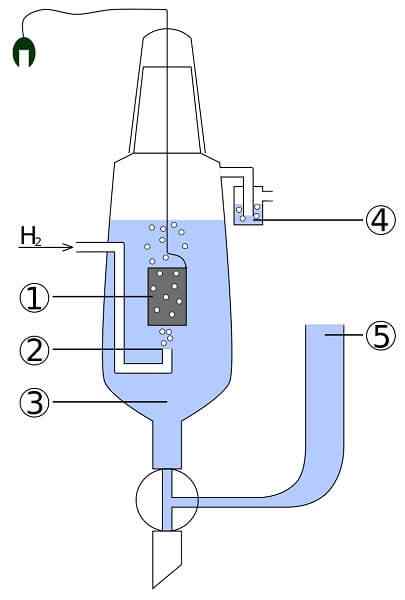 Skema sel platinum dan hidrogen: 1. 2 elektroda platinum. Gas Hidrogen 3. Larutan asam 4. Hidroseal 5. Deposit Union
Skema sel platinum dan hidrogen: 1. 2 elektroda platinum. Gas Hidrogen 3. Larutan asam 4. Hidroseal 5. Deposit Union Bayangkan sel yang mengonsumsi hidrogen gas, menghasilkan perak logam, dan pada saat yang sama dibutuhkan listrik. Ini adalah sel platinum dan hidrogen, dan reaksi umumnya adalah sebagai berikut:
2agcl + h2(g) → 2ag + 2h+ + 2cl-
Di sini, di kompartemen anoda kami memiliki elektroda platinum inert, terendam air dan di mana hidrogen gas dipompa. H2 teroksidasi menjadi h+ dan menghasilkan elektronnya untuk endapan susu AGCL di kompartemen katoda dengan elektroda perak logam. AGCL akan dikurangi pada perak ini dan adonan elektroda akan meningkat.
Sel ini dapat direpresentasikan sebagai:
Pt, h2 | H+ | | Cl-, Agcl | Ag
Sel downs
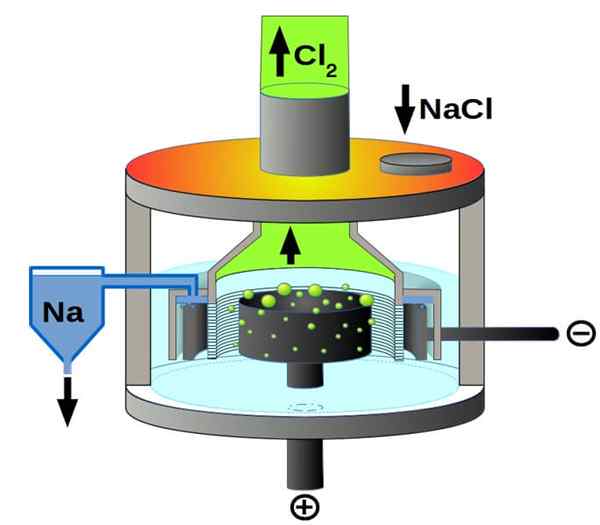 Skema sel Downs untuk elektrolisis natrium klorida. Sumber: pchemiker, cc by-sa 4.0, via Wikimedia Commons
Skema sel Downs untuk elektrolisis natrium klorida. Sumber: pchemiker, cc by-sa 4.0, via Wikimedia Commons Dan akhirnya, di antara sel -sel elektrolitik kami memiliki natrium klorida cair, lebih dikenal sebagai sel downs. Di sini listrik dibuat untuk melakukan perjalanan melalui elektroda volume NaCl cair, dan dengan demikian berasal dari mereka reaksi berikut:
2nd+(l) + 2e- → 2NA (Katoda)
2cl-(L) → CL2(g) + 2e- (anoda)
2NaCl (l) → 2NA (s) + cl2(g) (reaksi global)
Dengan demikian, berkat listrik dan natrium klorida, natrium logam dan gas klorin dapat disiapkan.

