Jenis Keton, Properti, Nomenklatur, Penggunaan, Contoh
- 3195
- 113
- Jessie Harvey
Itu keton Mereka adalah senyawa organik yang memiliki kelompok karbonil (-co). Mereka adalah senyawa sederhana di mana tulang karbon dari kelompok karbonil terkait dengan dua atom karbon (dan rantai substituennya)). Keton itu "sederhana" karena mereka tidak memiliki kelompok reaktif seperti -oh atau -cl bersatu untuk karbon.
Diakui sebagai senyawa kutub, keton biasanya larut dan mudah menguap, yang menjadikannya pelarut dan aditif yang baik untuk parfum. Selain itu, mereka mudah disiapkan, relatif stabil dan memiliki reaktivitas tinggi, yang telah menjadikannya senyawa perantara yang hampir sempurna untuk menyiapkan senyawa organik yang lebih kompleks.
 Formula keton umum
Formula keton umum Akhirnya, penghapusan keton dari tubuh manusia biasanya dikaitkan dengan tingkat gula yang rendah (dalam kasus penderita diabetes dan/atau puasa ekstrem), yang dapat menyebabkan masalah kesehatan yang serius bagi pasien.
[TOC]
Formula keton umum
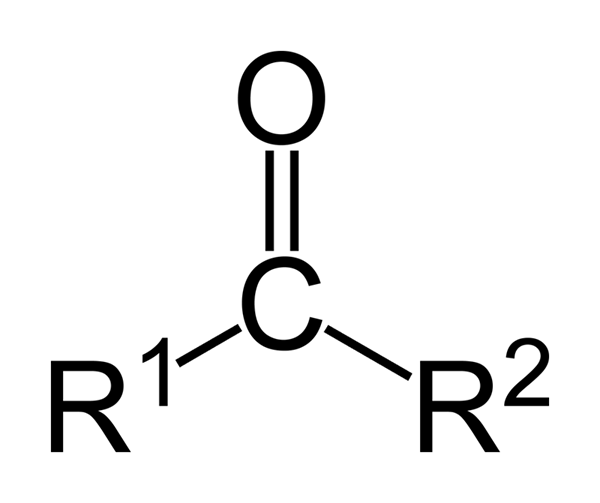
Keton adalah senyawa karbonil di mana kelompok ini terkait dengan dua kelompok hidrokarbon; Ini bisa berupa kelompok alkil, kelompok cincin benzena atau keduanya.
Keton dapat direpresentasikan hanya sebagai r- (c = o) -r ', di mana r dan r' adalah dua rantai hidrokarbon apa pun (alko, alkena, alkine, sikloalcanos, turunan dari benzena dan lainnya). Tidak ada keton dengan hidrogen yang melekat pada kelompok karbonil.
Ada berbagai macam metode untuk persiapan keton di bidang industri dan laboratorium; Selain itu, penting untuk dicatat bahwa keton dapat disintesis oleh organisme yang berbeda, termasuk manusia.
Dalam industri, metode yang paling umum untuk sintesis keton melibatkan oksidasi hidrokarbon, biasanya dengan penggunaan udara. Dalam skala kecil, keton biasanya disiapkan melalui oksidasi alkohol sekunder, yang memberikan produk cetona dan air sebagai produk.
Di luar metode yang paling umum ini, keton dapat disintesis melalui alkena, alkin, garam senyawa nitrogen, ester dan banyak senyawa lainnya, yang membuatnya mudah diperoleh.
Jenis keton
Ada beberapa klasifikasi untuk keton, terutama tergantung pada substituen dalam rantai r mereka. Klasifikasi paling umum untuk zat ini ditunjuk di bawah ini:
Menurut struktur rantainya
Dalam hal ini, keton diklasifikasikan dengan cara di mana rantainya terstruktur: keton alifatik adalah yang memiliki dua radikal R dan R yang memiliki bentuk radikal alkil (alkana, alkena, alkines dan sikloalcanos).
Itu dapat melayani Anda: isoamyl alkohol: struktur, sifat, penggunaan dan risikoDi sisi lain, aromatik adalah yang membentuk turunan dari benzena, sementara masih keton. Akhirnya, keton campuran adalah mereka yang memiliki aril alquilical dan radikal, atau sebaliknya.
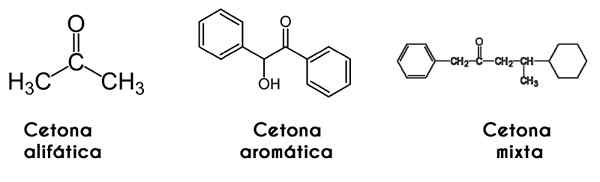 Dari kiri ke kanan: Propanona, Benzofrona dan Phenylmetilbutanone. Gambar Wikimedia Commons.
Dari kiri ke kanan: Propanona, Benzofrona dan Phenylmetilbutanone. Gambar Wikimedia Commons. Menurut simetri radikal mereka
Dalam hal ini, radikal R dan R dipelajari oleh kelompok karbonil; Ketika ini sama (identik) keton menyebut dirinya simetris; Tetapi ketika mereka berbeda (seperti kebanyakan keton), itu menyebut dirinya asimetris.
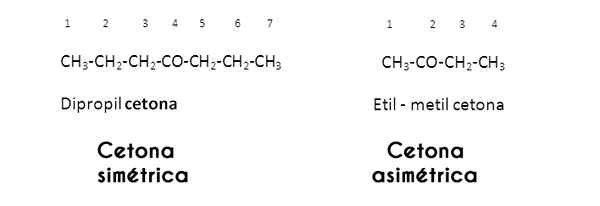 Gambar melalui Wikimedia Commons.
Gambar melalui Wikimedia Commons. Menurut saturasi radikalnya
Keton juga dapat diklasifikasikan sesuai dengan saturasi rantai karbon mereka; Jika ini dalam bentuk alkana, keton menyebut dirinya keton jenuh. Di sisi lain, jika rantai seperti alkena atau alkine, keton disebut keton tak jenuh.
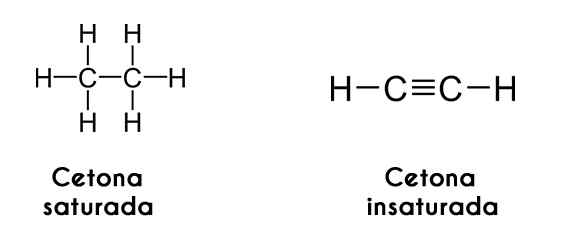 Di sebelah kiri, asetilena kanan. Gambar melalui Wikimedia Commons.
Di sebelah kiri, asetilena kanan. Gambar melalui Wikimedia Commons. Diketon
Ini adalah kelas yang terpisah dari Cetona, karena rantai keton ini memiliki dua kelompok karbonil dalam strukturnya. Beberapa keton ini memiliki karakteristik yang unik, seperti panjang tautan yang lebih besar antara karbon.
Misalnya, diceton yang berasal dari sikloheksan dikenal sebagai quinonas, yang hanya dua: orto-benzoquinone dan benzoquinone.
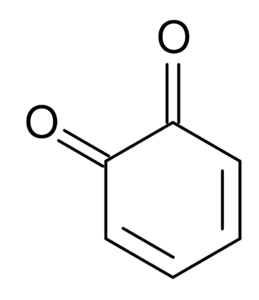 Ortho-Benzoquinone. Selatan di Wikipedia Inggris / Domain Publik
Ortho-Benzoquinone. Selatan di Wikipedia Inggris / Domain Publik Sifat fisik dan kimia keton
Keton, seperti kebanyakan aldehida, adalah molekul cair dan memiliki serangkaian sifat fisik dan kimia yang bervariasi tergantung pada panjang rantai mereka. Sifatnya dijelaskan di bawah ini:
Titik didih
Ketonnya sangat fluktuatif, sangat polar dan tidak dapat menyumbangkan hidrogen untuk ikatan hidrogen (mereka tidak memiliki atom hidrogen yang terkait dengan kelompok karbonil mereka), sehingga mereka memiliki titik didih yang lebih tinggi daripada alkena dan eter, tetapi lebih rendah dari alkohol dengan berat molekul yang sama.
Titik didih dari keton meningkat seiring dengan meningkatnya ukuran molekul. Hal ini disebabkan oleh intervensi gaya van der Waals dan dipolo-dipolo, yang membutuhkan jumlah energi yang lebih besar untuk memisahkan atom dan elektron yang tertarik dalam molekul.
Kelarutan
Kelarutan keton memiliki pengaruh yang kuat di bagian dari kapasitas molekul -molekul ini untuk menerima hidrogen dalam atom oksigennya dan dengan demikian membentuk ikatan hidrogen dengan air. Selain itu, kekuatan daya tarik, dispersi dan dipol-dipol antara keton dan air, yang meningkatkan efek larut mereka adalah kekuatan.
Dapat melayani Anda: besi (elemen): karakteristik, struktur kimia, penggunaanKeton kehilangan kapasitas kelarutan semakin besar molekul mereka, karena mereka mulai membutuhkan lebih banyak energi untuk larut dalam air. Mereka juga larut dalam senyawa organik.
Keasaman
Berkat kelompok karbonil mereka, keton memiliki sifat asam; Ini terjadi karena kapasitas stabilisasi resonansi yang dimiliki kelompok fungsional ini, yang dapat memberikan proton ikatan rangkap untuk membentuk basis terkonjugasi yang disebut enol.
Reaktivitas
Keton adalah bagian dari sejumlah besar reaksi organik; Ini terjadi karena kerentanan karbon karbonil terhadap penambahan nukleofilik, selain polaritas ini.
Seperti yang dinyatakan di atas, reaktivitas besar keton dibuat oleh produk perantara yang diakui yang berfungsi sebagai dasar untuk mensintesis senyawa lain.
Tata nama
Keton dinamai sesuai dengan prioritas atau pentingnya kelompok karbonil di seluruh molekul, jadi ketika Anda memiliki molekul yang diatur oleh kelompok karbonil, keton dinamai dengan menambahkan akhiran "-ona" ke nama hidrokarbon.
Dibutuhkan sebagai rantai utama yang memiliki panjang lebih besar yang dimiliki kelompok karbonil, dan kemudian molekul itu dinamai. Jika kelompok karbonil tidak memiliki prioritas daripada kelompok fungsional molekul lainnya, maka itu diidentifikasi dengan "-oxo".
Untuk keton yang lebih rumit, posisi kelompok fungsional dapat diidentifikasi dengan angka, dan dalam kasus diketon (keton dengan dua substituen R dan R 'identik), molekul ini dinamai dengan akhiran "-Diona".
Akhirnya, kata "cetona" juga dapat digunakan setelah mengidentifikasi rantai radikal yang terkait dengan kelompok fungsional karbonil.
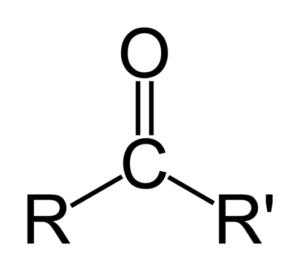
Perbedaan antara aldehida dan keton
Perbedaan terbesar antara aldehida dan keton adalah adanya atom hidrogen yang melekat pada kelompok karbonil di aldehida.
Atom ini memiliki efek penting ketika melibatkan molekul dalam reaksi oksidasi: aldehida akan membentuk asam karboksilat atau garam asam karboksilat, tergantung pada apakah oksidasi terjadi di bawah asam atau kondisi basa dalam kondisi atau kondisi basa.
Di sisi lain, cetona tidak memiliki hidrogen ini, sehingga langkah minimum yang diperlukan untuk oksidasi tidak terjadi.
Ada metode untuk mengoksidasi keton (dengan agen pengoksidasi jauh lebih kuat daripada yang biasanya digunakan), tetapi mereka memecahkan molekul ceton, memisahkannya terlebih dahulu menjadi dua atau lebih bagian.
Dapat melayani Anda: ionisasi dalam fisika dan kimia: konsep, proses dan contohPenggunaan kehidupan industri dan sehari -hari
Dalam industri ini, keton diamati pada parfum dan lukisan, mengambil kertas stabil dan kondom yang mencegah komponen lain dari campuran dari merendahkan; Mereka juga memiliki spektrum luas sebagai pelarut di industri yang memproduksi bahan peledak, lukisan dan tekstil, selain farmasi.
Aseton (keton terkecil dan lebih kecil) adalah dunia pelarut yang diakui dengan sangat baik.
Di alam, keton dapat muncul sebagai gula, yang disebut ketus. Ketosa adalah monosakarida yang mengandung cetona dengan molekul. Ketose yang paling terkenal adalah fruktosa, gula yang ditemukan dalam buah -buahan dan madu.
Biosintesis asam lemak yang terjadi dalam sitoplasma sel hewan juga terjadi dengan aksi keton. Akhirnya, dan seperti yang disebutkan di atas, mungkin ada peningkatan keton dalam darah setelah puasa atau dalam kasus diabetes.
Contoh keton
Butanona (C4H8SALAH SATU)
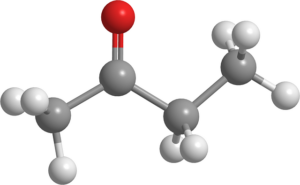 Molekul Butanone. Sumber: Pixabay.
Molekul Butanone. Sumber: Pixabay. Juga dikenal sebagai MEK (atau MEC), cairan ini diproduksi dalam skala besar di industri dan digunakan sebagai pelarut.
Sikloheksanon (c6H10SALAH SATU)
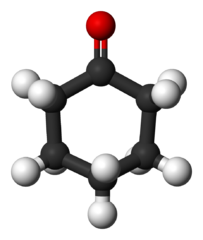 Molekul sikloheksanon. Benjah-bmm27 / domain publik
Molekul sikloheksanon. Benjah-bmm27 / domain publik Diproduksi dalam skala besar, keton ini digunakan sebagai prekursor bahan sintetis nilon.
Testosteron (c19H22SALAH SATU2)
 Molekul testosteron. Wikimedia Commons
Molekul testosteron. Wikimedia Commons Ini adalah hormon utama dari jenis kelamin pria dan steroid anabolik, ditemukan di sebagian besar vertebrata.
Progesteron (cdua puluh satuH30SALAH SATU2)
 Medroxiprogesterone asetat, komponen siklofemin
Medroxiprogesterone asetat, komponen siklofemin Steroid endogen dan hormon seksual yang terlibat dalam siklus menstruasi, kehamilan dan embriogenesis pada manusia dan spesies lainnya.
Aseton (Ch3(Co) ch3)
 Senyawa aseton. Benjah-bmm27 / domain publik
Senyawa aseton. Benjah-bmm27 / domain publik Juga dikenal sebagai Propanona, ini adalah senyawa yang tidak berwarna yang digunakan untuk pembuatan berbagai produk industri seperti plastik, serta untuk produk kebersihan rumah dan kosmetik seperti penghapusan.
Kortison (cdua puluh satuH28SALAH SATU5)
 Kortison. Benjah-bmm27 / domain publik
Kortison. Benjah-bmm27 / domain publik Hormon steroid yang digunakan untuk memerangi penyakit dan kondisi tertentu seperti radang, jerawat, alergi dan jenis reaksi kulit lainnya, asma atau kanker dan leukemia.
Benzofenona (c13H10SALAH SATU)
 Benzofenoma. Benjah-bmm27 / domain publik
Benzofenoma. Benjah-bmm27 / domain publik Senyawa banyak digunakan dalam penciptaan parfum dan produk kosmetik atau perlindungan matahari lainnya karena komposisi aromatiknya.
Referensi
- Wikipedia. (S.F.). Keton. Diperoleh dari dalam.Wikipedia.org
- Britannica, e. (S.F.). Keton. Diperoleh dari Britannica.com
- Universitas, m. S. (S.F.). Aldehida dan keton. Diperoleh dari kimia.MSU.Edu
- ChemGuide. (S.F.). Pendahuluan Aldehida dan Keton. Diperoleh dari ChemGuide.bersama.Inggris
- Calgary, u. SALAH SATU. (S.F.). Keton. Diperoleh dari kimia.Ucalgary.Ac

