Sifat kalium sianida (KCN), penggunaan, struktur, risiko,

- 669
- 159
- Dewey Runolfsdottir
Dia Kalium sianida Itu adalah senyawa anorganik yang dibentuk oleh kalium ion k+ dan ion sianida CN-. Formula kimianya adalah KCN. Itu adalah padatan putih kristal, sangat beracun.
KCN sangat larut dalam air dan saat melarutkannya dihidrolisis membentuk asam cyanhydric atau hcn hidrogen sianida, yang juga sangat beracun. Kalium sianida dapat membentuk garam senyawa dengan emas dan perak sehingga digunakan untuk mengekstrak logam mulia ini dari mineral tertentu.
 Kalium sianida kcn padat. Morienus (diunggah oleh DE: Benutzer: bxxxd dari: wiki) [cc by-sa 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Kalium sianida kcn padat. Morienus (diunggah oleh DE: Benutzer: bxxxd dari: wiki) [cc by-sa 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons. KCN digunakan untuk menutupi logam murah dengan emas dan perak melalui proses elektrokimia, yaitu metode di mana arus listrik dilewatkan melalui larutan yang mengandung garam yang terdiri dari logam mulia, sianida dan kalium.
Kalium sianida karena mengandung sianida harus dimanipulasi dengan sangat hati -hati, dengan alat yang memadai. Seharusnya tidak pernah dibuang ke lingkungan, karena juga sangat beracun bagi kebanyakan hewan dan tumbuhan.
Namun, metode yang menggunakan ganggang umum sedang dipelajari untuk menghilangkan kalium air yang terkontaminasi sianida dengan konsentrasi rendah ini.
[TOC]
Struktur
KCN adalah senyawa ionik yang dibentuk oleh kation kalium k+ dan cn anion sianida-. Dalam hal ini atom karbon terkait dengan atom nitrogen melalui ikatan kovalen tiga kali lipat.
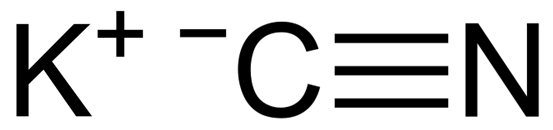 Struktur Kimia Kalium Sianida KCN. CAPACIO [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Struktur Kimia Kalium Sianida KCN. CAPACIO [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Dalam kalium solid sianida anion CN- Itu dapat diputar secara bebas oleh apa yang berperilaku seperti anion bola, sebagai akibatnya kristal KCN memiliki struktur kubik yang mirip dengan kalium KCL klorida KCL.
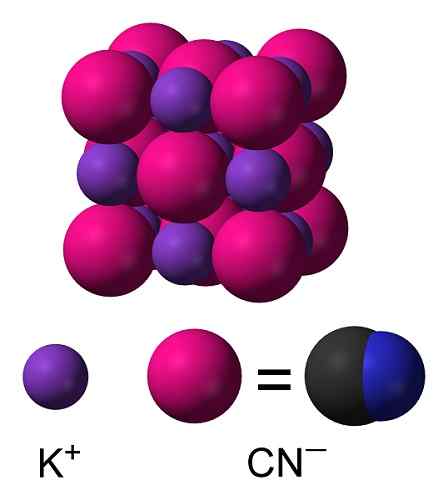 Struktur Kristal KCN. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons.
Struktur Kristal KCN. Benjah-BMM27 [Domain Publik]. Sumber: Wikimedia Commons. Tata nama
- Kalium sianida
- Kalium sianida
- Cianopotasio
Properti
Keadaan fisik
Solid kristal putih. Kristal kubik.
Berat molekul
65.116 g/mol.
Titik lebur
634.5 ° C
Itu dapat melayani Anda: aluminium sulfat (al2 (SO4) 3)Titik didih
1625 ° C.
Kepadatan
1,55 g/cm3 pada 20 ° C.
Kelarutan
Sangat larut dalam air: 716 g/L pada 25 ° C dan 100 g/100 ml air pada 80 ° C. Sedikit larut dalam metanol: 4,91 g/100 g metanol pada 19,5 ° C. Sangat sedikit larut dalam etanol: 0,57 g/100 g etanol pada 19,5 ° C.
ph
Larutan berair 6,5 g KCN dalam 1 L air memiliki pH 11.0.
Konstanta hidrolisis
KCN sangat larut dalam air. Saat ion sianida CN gratis- yang membutuhkan proton h+ air untuk membentuk asam hcn cyanhydric dan melepaskan ion OH-:
Cn- + H2O → hcn + oh-
Konstanta hidrolisis menunjukkan tren yang dilakukan reaksi tersebut.
KH = 2.54 x 10-5
KCN Larutan berair Lepaskan lingkungan sianida hidrogen HCN saat memanaskan 80 ° C.
Sifat kimia
Ini tidak mudah terbakar, tetapi ketika KCN padat dipanaskan sampai dekomposisinya memancarkan hidrogen sianida HCN yang sangat beracun, nitrogen oksida tidakX, K -Potassium oksida2O dan karbon monoksida.
KCN bereaksi dengan garam emas yang membentuk kalium aurocianuro kau (CN)2 dan Potassium Auricianuro Kau (CN)4. Ini adalah kompleks garam yang tidak berwarna. Dengan AG logam perak, KCN membentuk kalium argentocyanide kag (CN)2.
Ion sianida KCN bereaksi dengan senyawa organik tertentu yang memiliki halogen (seperti klorin atau brom) dan menempati tempatnya. Misalnya, bereaksi dengan asam bromoasetat untuk menghasilkan asam sianoasetat.
Properti lainnya
Itu higroskopis, menyerap kelembaban lingkungan.
Ini memiliki aroma lembut almond pahit, tetapi ini tidak terdeteksi oleh semua orang.
Memperoleh
KCN dibuat dengan reaksi KOH kalium hidroksida dalam larutan berair dengan HCN hidrogen sianida. Kalium ferrocyanide k juga diperoleh dengan pemanasan4Iman (CN)6:
K4Iman (CN)6 → 4 kcn + 2 c + n2↑ + Iman
Gunakan dalam elektroda logam
Ini digunakan dalam proses menutupi sedikit logam berharga dengan emas dan perak. Ini adalah proses elektrolitik, yaitu, listrik dilewatkan melalui larutan berair dengan garam yang sesuai.
Itu dapat melayani Anda: sulfur trioksida (SO3): struktur, sifat, risiko, penggunaanPerak
Kalium argentocyanide kag (CN) digunakan2 Untuk dilapisi dengan logam yang lebih murah (AG).
Ini ditempatkan dalam larutan kalium kag (CN) berair2, Di mana anoda atau kutub positif adalah batang perak murni (AG) dan katoda atau kutub negatif adalah logam murah yang ingin melapisi perak.
Saat arus listrik melewati larutan, perak diendapkan pada logam lainnya. Saat garam sianida digunakan, lapisan perak diendapkan dengan cara yang lebih halus, lebih kompak dan patuh daripada dalam larutan senyawa lain.
 Beberapa barang perhiasan ditutupi dengan perak menggunakan garam KCN. Penulis: Stocksnap. Sumber: Pixabay.
Beberapa barang perhiasan ditutupi dengan perak menggunakan garam KCN. Penulis: Stocksnap. Sumber: Pixabay. Emas
Demikian pula dalam kasus emas (AU), kalium aurocyanide kau (CN)2 dan Potassium Auricianuro Kau (CN)4 Logam lain digunakan untuk berwarna cokelat secara elektrolitik.
 Konektor listrik yang dilapisi emas mungkin menggunakan garam KCN. CJP24 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Konektor listrik yang dilapisi emas mungkin menggunakan garam KCN. CJP24 [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Penggunaan lainnya
Beberapa penggunaan kalium sianida lain disebutkan di bawah ini.
- Untuk proses industri pengerasan baja nitrorasi (penambahan nitrogen).
- Untuk pembersihan logam.
- Dalam proses pencetakan dan fotografi.
- Sebelumnya digunakan untuk ekstraksi emas dan perak dari mineral yang mengandungnya, tetapi kemudian digantikan oleh natrium nacn sianida yang lebih murah, meskipun sama -sama beracun.
- Sebagai insektisida untuk fumigasi pohon, kapal, mobil kereta api dan gudang.
- Sebagai reagen dalam kimia analitik, yaitu, untuk melakukan analisis kimia.
- Untuk menyiapkan senyawa kimia lainnya, seperti pewarna dan pewarna.
 Ekstraksi emas di Afrika Selatan pada tahun 1903 menggunakan KCN apa yang ada dalam polusi fana dari lingkungan sekitarnya. Argyll, John Douglas Sutherland Campbell, Adipati, 1845-1914; Creswicke, Louis [tidak ada batasan]. Sumber: Wikimedia Commons.
Ekstraksi emas di Afrika Selatan pada tahun 1903 menggunakan KCN apa yang ada dalam polusi fana dari lingkungan sekitarnya. Argyll, John Douglas Sutherland Campbell, Adipati, 1845-1914; Creswicke, Louis [tidak ada batasan]. Sumber: Wikimedia Commons. Risiko
KCN adalah senyawa yang sangat beracun untuk hewan dan sebagian besar tanaman dan mikroorganisme. Diklasifikasikan sebagai super beracun. Masih mematikan dalam jumlah yang sangat kecil.
Itu dapat melayani Anda: nikel klorida (NICL2): struktur, sifat, mendapatkan, menggunakanEfeknya yang berbahaya dapat terjadi dengan inhalasi, kontak dengan kulit atau mata, atau konsumsi. Menghambat banyak proses metabolisme, terutama protein darah yang berpartisipasi dalam transportasi oksigen seperti hemoglobin.
Ini mempengaruhi organ atau sistem yang lebih sensitif terhadap kurangnya oksigen, seperti sistem saraf pusat (otak), sistem kardiovaskular (jantung dan pembuluh darah) dan paru -paru.
 Kalium sianida adalah racun. Penulis: clker-free-vector-images. Sumber: Pixabay.
Kalium sianida adalah racun. Penulis: clker-free-vector-images. Sumber: Pixabay. Mekanisme aksi
KCN mengganggu kemampuan tubuh untuk menggunakan oksigen.
Ion sianida CN- dari KCN memiliki kedekatan yang besar untuk iman ferric3+, Yang berarti bahwa ketika sianida menyerapnya bereaksi dengan cepat dengan iman3+ Darah dan jaringan.
Dengan cara ini mencegah pernapasan sel, yang memasuki keadaan kurangnya oksigen, karena meskipun mereka mencoba bernafas, mereka tidak dapat menggunakannya.
Itu terjadi kemudian keadaan sementara Hipperapnea (suspensi pernapasan) dan sakit kepala, dan akhirnya mati dengan penangkapan pernapasan.
Risiko tambahan
Saat memanaskannya menghasilkan gas yang sangat beracun seperti HCN, nitrogen oksidaX, K -Potassium oksida2O dan karbon monoksida.
Setelah kontak dengan kelembaban HCN yang sangat mudah terbakar dan sangat beracun.
KCN juga sangat beracun untuk organisme akuatik. Itu tidak boleh dibuang ke lingkungan, karena polusi air dapat terjadi di mana mereka minum hewan dan menghuni ikan.
Namun, ada bakteri yang menghasilkan sianida seperti Chromobacterium violaceum dan beberapa spesies Pseudomonas.
Penelitian terkini
Peneliti tertentu menemukan bahwa ganggang hijau Chlorella vulgaris Ini dapat digunakan untuk mengolah air yang terkontaminasi dengan KCN kalium sianida dalam konsentrasi rendah.
Alga mampu menghilangkan KCN secara efisien, karena ini dalam jumlah rendah merangsang pertumbuhan alga karena mengaktifkan mekanisme internal untuk menahan toksisitas KCN.
Ini berarti alga Chlorella vulgaris Ini memiliki potensi untuk menghilangkan sianida dan metode yang efektif untuk pengobatan biologis kontaminasi sianida dapat dirancang dengan ini.
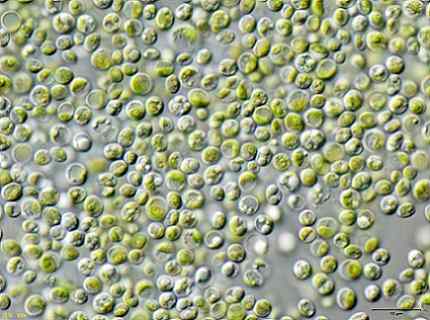 Gambar ganggang Chlorella vulgaris diamati dalam mikroskop. JA: Pengguna: Neon / Pengguna: Neon_ja [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Gambar ganggang Chlorella vulgaris diamati dalam mikroskop. JA: Pengguna: Neon / Pengguna: Neon_ja [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Kalium sianida. Pusat Nasional Informasi Bioteknologi. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Coppock, r.W. (2009). Ancaman terhadap satwa liar oleh agen perang kimia. Dalam Buku Pegangan Toksikologi Agen Perang Kimia. Pulih dari scientedirect.com.
- Liu, q. (2017). Evaluasi penghapusan kalium sianida dan toksisitasnya dalam ganggang hijau (Chlorella vulgaris). Lingkungan Bull Contam Toxicol. 2018; 100 (2): 228-233. NCBI pulih.Nlm.Nih.Pemerintah.
- Institut Nasional untuk Keselamatan dan Kesehatan Kerja (NIOSH). (2011). Kalium sianida: agen sistemik. CDC pulih.Pemerintah.
- Alvarado, l.J. et al. (2014). Penemuan, struktur dan fungsi riboswitch. Sintesis urasil. Dalam metode dalam enzimologi. Pulih dari scientedirect.com.
- « Struktur natrium tripoliphosphate (na5p3o10), sifat, penggunaan, dampak
- Karena saya sangat mengantuk? 9 Penyebab dan Solusi »

