Struktur Asam Karbonat (H2CO3), Sifat, Sintesis, Penggunaan

- 4094
- 649
- Leland Robel
Dia asam karbonat Ini adalah senyawa anorganik, meskipun ada orang yang berdebat bahwa itu sebenarnya organik, yang formulanya kimianya h2BERSAMA3. Oleh karena itu adalah asam diprotik, mampu menyumbangkan dua ion H+ ke lingkungan berair untuk menghasilkan dua kation molekul h3SALAH SATU+. Darinya ion bikarbonat yang terkenal muncul (HCO3-) dan karbonat (CO32-).
Asam aneh ini, sederhana, tetapi pada saat yang sama terlibat dalam sistem di mana banyak spesies berpartisipasi dalam keseimbangan uap cair, dibentuk dari dua molekul anorganik mendasar: air dan karbon dioksida. Kehadiran CO2 Unwound selalu diamati bahwa ada gelembung di dalam air, naik ke permukaan.
 Gelas dengan air gasifikasi, salah satu minuman paling umum yang mengandung asam karbonat. Sumber: Pxhere.
Gelas dengan air gasifikasi, salah satu minuman paling umum yang mengandung asam karbonat. Sumber: Pxhere. Fenomena ini secara teratur terlihat dalam minuman ringan dan air berkarbonasi.
Dalam kasus air berkarbonasi atau gasifikasi (gambar superior), jumlah tersebut telah dibubarkan2 bahwa tekanan uap Anda lebih dari tekanan atmosfer ganda. Dengan mengungkapnya, perbedaan tekanan di dalam botol dan eksterior mengurangi kelarutan CO2, Jadi gelembung yang akhirnya keluar dari cairan muncul.
Pada tingkat yang lebih rendah hal yang sama terjadi dalam massa air segar atau salin: ketika mereka memanaskannya, mereka akan melepaskan kandungan CO yang terlarut2.
Namun, CO2 Itu tidak hanya dibubarkan, tetapi menderita transformasi dalam molekulnya yang membuatnya h2BERSAMA3; Asam yang memiliki kehidupan yang sangat kecil, tetapi cukup untuk menandai perubahan pH dari lingkungan pelarut airnya, dan juga menghasilkan sistem penyangga karbonat yang unik.
[TOC]
Struktur
Molekul
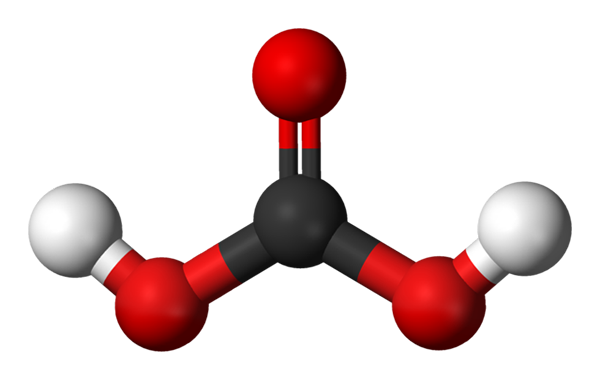 Molekul asam karbonat diwakili dengan model bola dan batang. Sumber: Jynto dan Ben Mills via Wikipedia.
Molekul asam karbonat diwakili dengan model bola dan batang. Sumber: Jynto dan Ben Mills via Wikipedia. KAMI MEMILIKI MOLEKUL H2BERSAMA3, diwakili dengan bola dan batang. Bola merah sesuai dengan atom oksigen, atom hitam hingga karbon, dan atom hidrogen putih.
Perhatikan bahwa mulai dari gambar Anda dapat menulis formula lain yang valid untuk asam ini: CO (OH)2, di mana co menjadi kelompok karbonil, c = o, terhubung ke dua kelompok hidroksil, oh. Ketika ada dua kelompok OH, mampu menyumbangkan atom hidrogen mereka, sekarang dipahami dari mana ion H berasal+ dirilis di tengah.
 Struktur molekul asam karbonat.
Struktur molekul asam karbonat. Perhatikan bahwa Formula Co (OH)2 Itu bisa ditulis sebagai ohcooh; yaitu, dari tipe rcooh, di mana r menjadi dalam hal ini kelompok OH.
Karena alasan inilah, selain fakta bahwa molekul terdiri dari atom oksigen, hidrogen dan karbon, terlalu umum dalam kimia organik, bahwa asam karbonat dianggap oleh beberapa orang sebagai senyawa organik. Namun, di bagian sintesisnya akan dijelaskan mengapa orang lain menganggapnya sebagai sifat anorganik dan non -organik.
Dapat melayani Anda: dihydroxyacetone: struktur, properti, memperoleh, penggunaanInteraksi molekuler
Dari molekul h2BERSAMA3 Dapat dikomentari bahwa geometrinya adalah trigonal flat, dengan karbon yang terletak di tengah segitiga. Dalam dua simpulnya memiliki kelompok OH, yang merupakan donor jembatan hidrogen; Dan di yang lain yang tersisa, atom oksigen dari kelompok C = O, akseptor jembatan hidrogen.
Jadi, h2BERSAMA3 Ini memiliki kecenderungan kuat untuk berinteraksi dengan protik atau pelarut teroksigenasi (dan juga nitrogen).
Dan secara kebetulan, air memenuhi dua karakteristik ini, dan afinitas h adalah seperti itu2BERSAMA3 baginya yang segera memberinya h+ Dan keseimbangan hidrolisis yang melibatkan spesies HCO mulai didirikan3- dan H3SALAH SATU+.
Itulah sebabnya keberadaan air hanya membusuk asam karbonat dan menjadikan isolasi sebagai senyawa murni terlalu rumit.
Asam karbonat murni
Kembali ke molekul H2BERSAMA3, Tidak hanya datar, mampu membangun jembatan hidrogen, tetapi juga dapat menghadirkan cis-trans isomeía; Ini adalah, dalam gambar kita memiliki isomer cis, dengan dua jam menunjuk ke arah yang sama, sedangkan di isomer trans mereka akan menunjuk ke arah yang berlawanan.
Isomer cis adalah yang paling stabil dari keduanya, dan itulah sebabnya itu adalah satu -satunya yang biasanya diwakili.
Padatan murni dari h2BERSAMA3 Ini terdiri dari struktur kristal yang terdiri dari lapisan atau molekul daun yang berinteraksi dengan jembatan hidrogen samping. Ini diharapkan, menjadi molekul h2BERSAMA3 Datar dan segitiga. Saat sublimal, senja siklik muncul (h2BERSAMA3)2, yang bergabung dengan dua jembatan hidrogen c = o - oh.
Simetri SDM2BERSAMA3 Itu belum dapat ditentukan oleh momen. Itu dianggap mengkristal sebagai dua polimorf: α-h2BERSAMA3 dan β- H2BERSAMA3. Namun, α-H2BERSAMA3, disintesis berdasarkan campuran cho3Cooh-co2, Itu ditunjukkan bahwa itu sebenarnya cho3OROH: Ster Asam Karbonat Monometri.
Properti
Disebutkan bahwa h2BERSAMA3 Ini adalah asam diprotik, jadi Anda dapat menyumbangkan dua ion H+ ke media yang menerimanya. Ketika media ini adalah air, persamaan disosiasi atau hidrolisisnya adalah:
H2BERSAMA3(Ac) + h2Atau (l) hco3-(Ac) + h3SALAH SATU+(AC) (ka1 = 2.5 × 10−4)
HCO3-(Ac) + h2Atau (l) co32-(Ac) + h3SALAH SATU+(AC) (ka2 = 4.69 × 10−11)
HCO3- Itu adalah anion bikarbonat atau hidrogenokarbonat, dan CO32- Anion karbonat. Mereka juga menunjukkan konstanta keseimbangan masing -masing, ka1 dan ka2. Menjadi ka2 lima juta kali lebih kecil dari KA1, Pembentukan dan konsentrasi CO32- Mereka tercela.
Jadi, bahkan jika itu adalah asam diprotik, yang kedua H+ Anda hampir tidak bisa merilisnya. Namun, kehadiran CO2 Dilarahkan dalam jumlah besar cukup untuk mengasamkan medium; Dalam hal ini, air, menurunkan nilai pH (di bawah 7).
Dapat melayani Anda: FusionBerbicara tentang asam karbonik praktis mengacu pada larutan berair di mana spesies HCO mendominasi3- dan H3SALAH SATU+; Itu tidak dapat diisolasi dengan metode konvensional, karena upaya paling sedikit akan menggantikan keseimbangan kelarutan CO2 ke pembentukan gelembung yang akan keluar dari air.
Perpaduan
Pembubaran
Asam karbonat adalah salah satu senyawa termudah untuk disintesis. Sebagai? Metode paling sederhana adalah menggelembung, dengan bantuan sedotan atau sorbet, udara yang kita napas di dalam volume air. Karena kita menghembuskan napas pada intinya co2, Gelembung ini di dalam air, melarutkan sebagian kecil.
Ketika kita melakukan ini, reaksi berikut terjadi:
BERSAMA2(g) + h2Atau (l) h2BERSAMA3(AC)
Namun pada gilirannya, kelarutan CO harus dipertimbangkan2 di air:
BERSAMA2(g) CO2(AC)
Keduanya co2 seperti h2Atau molekul anorganik, jadi h2BERSAMA3 Itu anorganik sejak saat ini terlihat.
Keseimbangan uap cair
Akibatnya kami memiliki sistem dalam keseimbangan yang sangat tergantung pada tekanan parsial CO2, serta suhu cair.
Misalnya, jika tekanan CO2 Itu meningkat (dalam hal kami meniup udara dengan lebih banyak kekuatan melalui sorbet), lebih banyak H akan terbentuk2BERSAMA3 dan pH akan menjadi lebih asam; Sejak, keseimbangan pertama bergerak ke kanan.
Di sisi lain, jika kita memanaskan pembubaran h2BERSAMA3, Kelarutan CO akan berkurang2 Di dalam air karena itu adalah gas, dan keseimbangan kemudian akan bergerak ke kiri (akan ada lebih sedikit h2BERSAMA3). Serupa adalah jika kita mencoba menerapkan kekosongan: co2 Itu akan keluar serta molekul air, yang akan memindahkan keseimbangan ke kiri lagi.
Solid murni
Di atas memungkinkan untuk mencapai kesimpulan: dari solusi h2BERSAMA3 Tidak ada cara untuk mensintesis asam ini sebagai padatan murni melalui metode konvensional. Namun, itu telah dilakukan, sejak 90 -an abad terakhir, mulai dari campuran CO yang padat2 dan H2SALAH SATU.
Ke CO campuran padat ini2-H2Atau pada 50% dibombardir dengan proton (sejenis radiasi kosmik), sehingga tidak satu pun dari dua komponen yang akan keluar dan pembentukan h terjadi2BERSAMA3. Untuk tujuan ini, campuran CHO juga telah digunakan3Oh-co2 (Ingat α-H2BERSAMA3).
Metode lain adalah melakukan hal yang sama tetapi langsung menggunakan es kering, tidak lebih.
Dari tiga metode, para ilmuwan NASA dapat mencapai kesimpulan: asam karbonat murni, padat atau gas, dapat ada dalam es krim Jupiter, di gletser Mars, dan dalam komet, di mana campuran padat seperti itu terus -menerus diiradiasi untuk sinar kosmik kosmik.
Dapat melayani Anda: Pipet Volumetrik: Karakteristik, Penggunaan, Kalibrasi dan KesalahanAplikasi
Asam karbonat itu sendiri adalah senyawa tanpa utilitas apa pun. Namun, dari solusinya, Anda dapat menyiapkan solusi redaman berdasarkan rekan HCO3-/BERSAMA32- atau h2BERSAMA3/Hco3-.
Berkat solusi ini dan aksi enzim anhidrase karbonik, hadir dalam sel darah merah, CO2 Diproduksi dalam pernapasan dapat diangkut dalam darah ke paru -paru, di mana akhirnya dilepaskan untuk dihembuskan di luar tubuh kita.
Bubjueo dari CO2 Itu memanfaatkan minuman gaseing sensasi yang menyenangkan dan khas yang mereka tinggalkan di tenggorokan saat meminumnya.
Juga, kehadiran h2BERSAMA3 Ini memiliki kepentingan geologis dalam pembentukan stalaktit batu kapur, karena melarutkan mereka secara perlahan sampai mereka berasal dari hasil akhir yang runcing.
Dan di sisi lain, solusinya dapat digunakan untuk menyiapkan beberapa bikarbonat logam; Meskipun lebih menguntungkan dan mudah menggunakan garam bikarbonat (Nahco3, Misalnya).
Risiko
Asam karbonat memiliki kehidupan yang sangat kecil dalam kondisi normal (mereka memperkirakan bahwa sekitar 300 nanodetik), yang praktis tidak berbahaya bagi lingkungan dan makhluk hidup. Namun, seperti yang dinyatakan sebelumnya, itu tidak menyiratkan bahwa itu tidak dapat menghasilkan perubahan yang mengkhawatirkan dalam pH air laut, yang mempengaruhi fauna laut.
Di sisi lain, "risiko" yang sebenarnya ada di asupan air yang diberi gasi, karena jumlah CO2 Dilarahkan di dalamnya jauh lebih besar daripada di air normal. Namun, dan sekali lagi, tidak ada penelitian yang menunjukkan bahwa minum air yang dikembalikan merupakan risiko mematikan; Jika Anda bahkan merekomendasikannya untuk berpuasa dan memerangi gangguan pencernaan.
Satu -satunya efek negatif yang diamati pada mereka yang minum air ini adalah perasaan penuh, karena perut mereka diisi dengan gas. Dari ini (belum lagi minuman ringan, karena mereka terdiri dari lebih dari sekadar asam karbonat), dapat dikatakan bahwa senyawa ini tidak beracun sama sekali.
Referensi
- Hari, r., & Underwood, a. (1989). Kimia analitik kuantitatif (ed kelima.). Pearson Prentice Hall.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). ASAM KARBONAT. Diperoleh dari: di.Wikipedia.org
- Danielle Reid. (2019). Asam karbonat: Video Persamaan Formasi, Struktur & Kimia. Belajar. Pulih dari: belajar.com
- Götz Bucher & Wolfram Sander. (2014). Mengklarifikasi struktur asam karbonat. Vol. 346, edisi 6209, pp. 544-545. Doi: 10.1126/Sains.1260117
- Lynn Yarris. (22 Oktober 2014). Wawasan baru tentang asam karbonat dalam air. Berkeley Lab. Pulih dari: newscenter.lbl.Pemerintah
- Claudia Hammond. (14 September 2015). Apakah air bersoda sangat buruk untukmu? Diperoleh dari: BBC.com
- Jürgen Bernard. (2014). Asam karbonat padat dan gas. Institut Kimia Fisik. Universitas Innsbruck.
- « Undang -undang perpindahan panas, bentuk transmisi, contoh
- 15 Manfaat apel untuk kesehatan fisik dan mental »

