Struktur molekul asam cyanhydric, sifat, penggunaan

- 2615
- 266
- Domingo Gutkowski
Dia Asam Hidrosianat o Hidrogen sianida adalah senyawa organik yang formula kimianya hcn. Itu juga dikenal sebagai metanonitril.
Asam cyanhydric adalah gas yang tidak berwarna, sangat beracun, yang diperoleh saat mengobati sianida dengan asam. Asam ini terletak di dalam biji kacang polong, juga dikenal di banyak tempat sebagai buah persik.
 Biji persik, yang mengandung hidrogen sianida atau hidrogen sianida, HCN. Sebuah.Ha [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikipedia Commons.
Biji persik, yang mengandung hidrogen sianida atau hidrogen sianida, HCN. Sebuah.Ha [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikipedia Commons. Pada suhu sekitar kurang dari 25 ºC adalah cairan dan di atas suhu itu adalah gas. Dalam kedua kasus ini sangat beracun bagi manusia, hewan dan bahkan mayoritas mikroorganisme yang tidak teraklimatisasi untuk itu. Ini adalah pelarut yang baik untuk ion. Itu sangat tidak stabil karena cenderung mudah dipolimerisasi.
Ditemukan di kerajaan sayuran yang digabungkan dalam molekul beberapa glukosida, karena ketika mereka dihidrolisis oleh enzim sayuran, HCN, glukosa dan benzaldehida diperoleh.
Glukosida ini berada di dalam benih buah -buahan tertentu seperti buah persik, aprikot, ceri, plum dan almond pahit, jadi mereka tidak boleh dicerna.
Itu juga ditemukan pada tanaman seperti beberapa jenis sorgum. Selain itu, beberapa bakteri memproduksinya selama metabolisme mereka. Sebagian besar digunakan dalam produksi polimer dan dalam beberapa proses metalurgi.
HCN adalah racun yang mematikan karena inhalasi, konsumsi dan kontak. Itu ada dalam asap rokok dan dalam asap api plastik dan bahan yang mengandung karbon dan nitrogen. Itu dianggap sebagai polutan udara terjadi selama pembakaran bahan organik dari area yang luas di planet ini.
[TOC]
Struktur molekul dan konfigurasi elektronik
Hidrogen sianida atau asam sianida adalah senyawa molekul kovalen, dengan atom hidrogen, karbon dan salah satu nitrogen.
Atom karbon dan nitrogen berbagi 3 pasang elektron, sehingga mereka membentuk triple link. Hidrogen terkait dengan karbon, yang dengan persatuan ini menyajikan Valencia de Cuatro dan oktet elektron lengkapnya.
Nitrogen menghadirkan lima valencia lima dan untuk menyelesaikan oktetnya memiliki sepasang elektron yang hilang atau kesepian yang terletak di lateral.
Oleh karena itu HCN adalah molekul yang sepenuhnya linier, dengan beberapa elektron yang hilang yang terletak di lateral dalam nitrogen.
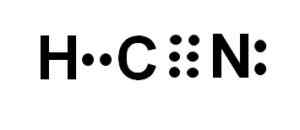 Representasi Lewis dari asam cyanhydric, di mana elektron yang dibagikan di setiap ikatan dan pasangan elektron nitrogen kesepian diamati. Penulis: Marilú Stea.
Representasi Lewis dari asam cyanhydric, di mana elektron yang dibagikan di setiap ikatan dan pasangan elektron nitrogen kesepian diamati. Penulis: Marilú Stea. 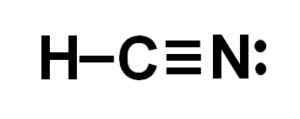 Struktur hidrogen sianida atau hidrogen sianida di mana ikatan tripel antara karbon dan nitrogen diamati. Penulis: Marilú Stea.
Struktur hidrogen sianida atau hidrogen sianida di mana ikatan tripel antara karbon dan nitrogen diamati. Penulis: Marilú Stea. Tata nama
- Asam Hidrosianat
- Hidrogen sianida
- Metanonitril
- Formonitrile
- Asam Hidrosianat
Properti
Keadaan fisik
Di bawah 25,6 ºC, jika anhidrat dan distabilkan, itu adalah cairan biru pucat atau biru yang sangat tidak stabil dan beracun. Jika di atas suhu itu adalah gas tidak berwarna yang sangat beracun.
Berat molekul
27.03 g/mol
Titik lebur
-13.28 ºC
Titik didih
25.63 ºC (Perhatikan bahwa itu mendidih tepat di atas suhu sekitar).
Titik nyala
-18 ºC (metode cangkir tertutup)
Suhu pengarahan diri sendiri
538 ºC
Dapat melayani Anda: kromatografi gasKepadatan
0.6875 g/cm3 pada 20 ºC
Kelarutan
Benar -benar larut dengan air, etil alkohol dan etil eter.
Konstan disosiasi
K = 2.1 x 10-9
Pkke = 9.2 (itu adalah asam yang sangat lemah)
Beberapa sifat kimia
HCN memiliki konstanta dielektrik yang sangat tinggi (107 hingga 25 ° C). Ini karena molekulnya sangat polar dan dikaitkan dengan jembatan hidrogen, seperti dalam kasus air h2SALAH SATU.
Untuk memiliki konstanta dielektrik yang tinggi, HCN ternyata menjadi pelarut pengion yang baik.
HCN anhidrat cair sangat tidak stabil, cenderung cenderung memolimerisasi dengan keras. Untuk menghindari hal ini, penstabil ditambahkan, sebagai persentase kecil dari H2Sw4.
Dalam larutan berair dan dengan adanya amonia dan bentuk adenin tekanan tinggi, senyawa yang merupakan bagian dari DNA dan RNA, yaitu, molekul yang penting secara biologis.
Ini adalah asam yang sangat lemah, karena konstanta ionisasi sangat kecil, jadi hanya sebagian dalam air yang memberikan cn anion sianida-. Membentuk garam dengan basis tetapi tidak dengan karbonat.
Solusi berairnya yang tidak terlindung dari cahaya perlahan -lahan membusuk menghasilkan amonium formiatri hcoonh4.
Dalam solusi itu menyajikan bau almond yang lemah.
Korosivitas
Karena itu adalah asam lemah, umumnya tidak korosif.
Namun, larutan berair HCN yang mengandung asam sulfat sebagai penstabil sangat menyerang baja pada suhu yang lebih besar dari 40 ºC dan baja tahan karat pada suhu lebih besar dari 80 ° C.
Selain itu, hCN larutan berair encer dapat menyebabkan baja karbon bahkan pada suhu kamar.
Anda juga dapat menyerang beberapa jenis karet, plastik dan pelapis.
Lokasi di alam
Itu relatif berlimpah di kerajaan tanaman menjadi bagian dari glukosida.
Misalnya, itu dihasilkan dari tonsilin C6H5-CH (-CN) -O-GLYCOSE-GLYCOSE, senyawa hadir dalam almond pahit. Bondoknya adalah beta-glukosida sianogenik, karena ketika dihidrolisisnya membentuk dua molekul glukosa, salah satu benzaldehida dan salah satu hcn. Enzim yang melepaskannya adalah beta-glukoksidase.
Bondok dapat ditemukan di biji persik, aprikot, almond pahit, ceri dan plum.
Beberapa jenis tanaman sorgum mengandung sianogenik glucóside yang disebut durrina (yaitu, p-hydroxy- (S) -Mandelonitrilo-beta-d-glukosida). Senyawa ini dapat terdegradasi oleh hidrolisis enzimatik dua langkah.
Pertama, enzim durrinosa yang endogen pada tanaman sorgum hidrolis dengan glukosa dan p-hydroxy- (S) -Mandelonitrilo. Kemudian, yang terakhir dengan cepat menjadi HCN gratis dan p-hydroxibenzaldehyde.
 Tanaman sorgum dengan kandungan durrina tinggi. Tidak ada penulis yang dapat dibaca mesin. Pethan diasumsikan (berdasarkan klaim hak cipta). [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikipedia Commons.
Tanaman sorgum dengan kandungan durrina tinggi. Tidak ada penulis yang dapat dibaca mesin. Pethan diasumsikan (berdasarkan klaim hak cipta). [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikipedia Commons. HCN bertanggung jawab atas resistensi tanaman sorgum terhadap hama dan patogen.
Ini dijelaskan oleh fakta bahwa enzim Durrina dan Durrinosa memiliki lokasi yang berbeda di tanaman ini, dan bersentuhan hanya ketika jaringan terluka atau dihancurkan, melepaskan HCN dan melindungi tanaman infeksi yang dapat menembus melalui partai yang terluka itu.
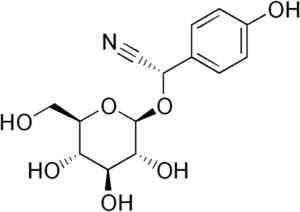 Molekul Durrina di mana ikatan triple CN diamati bahwa dengan hidrolisis enzimatik menghasilkan HCN. Edgar181 [domain publik]. Sumber: Wikipedia Commons.
Molekul Durrina di mana ikatan triple CN diamati bahwa dengan hidrolisis enzimatik menghasilkan HCN. Edgar181 [domain publik]. Sumber: Wikipedia Commons. Selain itu, beberapa bakteri patogenik manusia seperti Pseudomonas aeruginosa Dan P. Gingivalis Mereka memproduksinya selama aktivitas metabolisme mereka.
Aplikasi
Dalam persiapan senyawa kimia dan polimer lainnya
Penggunaan yang melibatkan sebagian besar HCN yang diproduksi di tingkat industri adalah persiapan perantara untuk sintesis organik.
Dapat melayani Anda: besi oksida (ii): struktur, nomenklatur, sifat, penggunaanIni digunakan dalam sintesis adiponitril NC- (ch2)4-CN, yang digunakan untuk menyiapkan nilon atau nilon, poliamida. Ini juga berfungsi untuk menyiapkan acrilonitrilo atau cianoethylene cho2= CH-CN, digunakan untuk menyiapkan serat akrilik dan plastik.
Sodium sianida turunannya digunakan untuk pemulihan emas dalam penambangan logam ini.
Lain dari turunannya cyanogen cyanogen chloride berfungsi untuk formula pestisida.
HCN digunakan untuk persiapan agen chelating seperti EDTA (ethylen-diamino-tetra-acetato).
Ini berfungsi untuk pembuatan ferrocyanides dan beberapa produk farmasi.
Berbagai kegunaan
Gas HCN telah digunakan sebagai insektisida, fungisida dan desinfektan, untuk fumigasi kapal dan bangunan. Juga untuk fumigasi furnitur untuk mengembalikannya.
HCN telah digunakan dalam cat logam.
Karena toksisitasnya yang sangat tinggi ia ditunjuk sebagai agen perang kimia.
Di bidang pertanian
Itu telah digunakan sebagai herbisida dan pestisida di kebun. Dia telah digunakan untuk mengendalikan timbangan dan patogen pohon jeruk lainnya, tetapi beberapa hama ini telah menjadi resisten terhadap HCN.
Itu juga telah digunakan untuk fumigasi silo biji -bijian. HCN gas yang disiapkan di situs telah digunakan dalam fumigasi biji -bijian gandum untuk melestarikannya dari hama seperti serangga, jamur dan hewan pengerat. Untuk penggunaan ini, sangat penting bahwa benih untuk difumigasi ke agen pestisida.
Tes Mengembangkan biji gandum telah dilakukan dengan HCN dan telah ditemukan bahwa potensi perkecambahan ini tidak berdampak negatif, melainkan mendukungnya.
Namun, dosis tinggi HCN dapat secara signifikan mengurangi panjang daun kecil yang tumbuh dari biji.
Di sisi lain, karena fakta bahwa itu adalah nematicide yang kuat dan bahwa beberapa tanaman sorgum memilikinya di jaringan mereka, potensi tanaman sorgum sedang diselidiki untuk digunakan sebagai pupuk hijau biosid.
Penggunaannya akan berfungsi untuk meningkatkan tanah, menekan gulma dan mengendalikan penyakit dan kerusakan yang disebabkan oleh nematoda phytoparasitic.
Risiko
Bagi manusia, HCN adalah racun yang mematikan di semua rute: inhalasi, konsumsi dan kontak.
 Penulis: clker-free-vector-images. Sumber: Pixabay.
Penulis: clker-free-vector-images. Sumber: Pixabay. Inhalasi bisa mematikan. Diperkirakan sekitar 60-70% dari populasi dapat mendeteksi bau almond HCN pahit ketika berada di udara pada konsentrasi 1-5 ppm.
Tetapi ada 20% dari populasi yang masih tidak dapat mendeteksinya pada konsentrasi mematikan karena secara genetik tidak dapat melakukannya.
Dicerna adalah racun tindakan akut dan langsung.
Jika solusi Anda bersentuhan dengan kulit, sianida terkait bisa mematikan.
HCN hadir dalam asap rokok dan yang dihasilkan saat plastik yang mengandung nitrogen dibakar.
Mekanisme aksi mematikan dalam organisme
Ini adalah bahan kimia dan dengan cepat beracun, sering menyebabkan kematian. Setelah memasuki organisme, ia bergabung dengan metalloenzymes (enzim yang mengandung ion logam) yang menonaktifkannya. Ini adalah agen beracun untuk beberapa organ tubuh manusia
Efek toksik utamanya terdiri dalam penghambatan respirasi seluler, karena menonaktifkan enzim yang mempengaruhi fosforilasi dalam mitokondria, yang merupakan organel yang mengintervensi, antara lain, dalam fungsi pernapasan sel.
Dapat melayani Anda: kalium permanganat (kmno4)Risiko asap rokok
HCN hadir dalam asap rokok.
Meskipun banyak orang tahu efek meracuni HCN, hanya sedikit orang yang menyadari bahwa mereka terpapar efek berbahaya mereka melalui asap rokok.
HCN adalah salah satu penyebab penghambatan beberapa enzim pernapasan sel. Jumlah HCN yang ada dalam asap rokok memiliki efek berbahaya pada sistem saraf.
Tingkat HCN telah dilaporkan dalam asap rokok antara 10 dan 400 μg per rokok untuk asap secara langsung dan 0,006 hingga 0,27 μg/rokok untuk inhalasi sekunder (perokok pasif). HCN menghasilkan efek toksik dari 40 μm dan seterusnya.
 Penulis: Foto Alexas. Sumber: Pixabay.
Penulis: Foto Alexas. Sumber: Pixabay. Dihirup dengan cepat memasuki aliran darah, di mana ia dilepaskan dalam plasma atau berikatan dengan hemoglobin. Sebagian kecil diubah menjadi Tiocianato dan diekskresikan oleh urin.
Risiko pemanasan HCN
Paparan yang berkepanjangan terhadap panas HCN cair dalam wadah tertutup dapat menyebabkan pecahnya kekerasan dan tidak terduga. Ini dapat secara eksplosif memolimerisasi 50-60 ºC di hadapan jejak alkali dan tanpa adanya inhibitor.
Kehadiran HCN dalam asap api
HCN dilepaskan selama pembakaran polimer yang mengandung nitrogen, seperti wol, sutra, poliacrylonitrilos dan nilon, antara lain. Bahan -bahan ini ada di rumah kita dan di sebagian besar lokasi aktivitas manusia.
Untuk alasan ini selama kebakaran, HCN berpotensi menjadi penyebab kematian karena menghirup.
Suasana polutan
HCN adalah polutan troposfer. Itu tahan terhadap photólysis dan di bawah kondisi lingkungan atmosfer tidak menderita hidrolisis.
OH Radikal Hydroxyl • Diproduksi secara fotokimia dapat bereaksi dengan HCN, tetapi reaksinya sangat lambat, sehingga setengah kehidupan HCN di atmosfer adalah 2 tahun.
Saat biomassa terbakar, terutama massa, HCN dilepaskan ke atmosfer, dan juga selama kegiatan industri. Namun, pembakaran gambut adalah 5 hingga 10 kali lebih banyak mencemari daripada membakar jenis biomassa lainnya.
Beberapa peneliti telah menemukan bahwa suhu tinggi dan kekeringan yang disebabkan oleh fenomena El Nino di daerah tertentu di planet ini.
 Penulis: Steve Buissinne. Sumber: Pixabay.
Penulis: Steve Buissinne. Sumber: Pixabay. Hal ini menyebabkan pembakaran biomassa yang intens di stasiun kering.
Peristiwa ini adalah sumber konsentrasi tinggi HCN di troposfer, yang akhirnya diangkut ke stratosfer rendah, tetap untuk waktu yang sangat lama.
Referensi
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Hidrogen sianida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Gidlow, d. (2017). Pembaruan hidrogen sianida-an. Kedokteran Kerja 2017; 67: 662-663. NCBI pulih.Nlm.Nih.Pemerintah.
- Ensiklopedia ilmiah Van Nostrand. (2005). Hidrogen sianida. 9th Diperoleh dari perpustakaan online.Wiley.com.
- Ren, dan.-L. et al. (seribu sembilan ratus sembilan puluh enam). Efek hidrogen sianida dan karbonil sulfida pada perkecambahan dan kekuatan plumul gandum. Pestis. Sci. 1996, 47, 1-5. Diperoleh dari perpustakaan online.Wiley.com.
- Dari Nicola, G.R. et al. (2011). Untuk metode analitik sederhana untuk evaluasi konten dhurrin pada tanaman sianogenik untuk penggunaannya dalam pakan ternak dan biofumigasi. J. Agric. Makanan makanan. 2011, 59, 8065-8069. Pulih dari pub.ACS.org.
- Sheese, p.DAN. et al. (2017). Peningkatan global hidrogen sianida di stratosfer bawah 2016. Geofy. Daging sapi. Lett., 44, 5791-5797. Pulih dari agupubs.Perpustakaan Online.Wiley.com.
- Surleva, a.R. dan drochioiu, g. (2013). Visualisasi Bahaya Merokok: Penentuan spektrofotometri sederhana hidrogen sianida dalam asap dan filter rokok. J. Chem. Educ. 2013, 90, 1654-1657. Pulih dari pub.ACS.org.
- Alarie, dan. et al. (1990). Peran hidrogen sianida dalam kematian manusia dalam api. Dalam api dan polimer. bagian 3. Seri Simposium ACS. Pulih dari pub.ACS.org.
- « Struktur asam kromik, sifat, memperoleh, menggunakan
- 8 Eksperimen dengan manusia yang sangat kontroversial »

