Struktur asam kromik, sifat, memperoleh, menggunakan

- 3752
- 77
- Leland Robel
Dia Asam Kromik atau h2Cro4 Asam yang terkait dengan kromium oksida (VI) atau cro cromic oksida secara teoritis3. Denominasi ini disebabkan oleh fakta bahwa dalam larutan encer asam oksida kromi spesies h2Cro4 Ini hadir dengan spesies kromium lainnya (VI).
Oksida cromic3 Itu juga disebut asam kromi anhidrat. Cro3 Ini adalah padatan coklat kemerahan atau ungu yang diperoleh saat mengobati solusi kalium dikromat k2Cr2SALAH SATU7 Dengan asam sulfat h2Sw4.
 Cromic oxide naksir3 Di dalam panci peleburan. Rando Tuikene [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikipedia Commons.
Cromic oxide naksir3 Di dalam panci peleburan. Rando Tuikene [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikipedia Commons. Larutan oksida kromik berair mengalami keseimbangan spesies kimia tertentu yang konsentrasinya tergantung pada pH larutan. PH dasar mendominasi ion cro cro42-, Sedangkan ion asam hcro mendominasi4- dan cr dicromato2SALAH SATU72-. Diperkirakan asam asam juga ada asam kromik H2Cro4.
Karena kekuatan pengoksidasi yang hebat, larutan asam kromik digunakan dalam kimia organik untuk melakukan reaksi oksidasi. Mereka juga digunakan dalam proses elektrokimia untuk mengobati logam sehingga mereka memperoleh resistensi terhadap korosi dan keausan.
Bahan polimer tertentu juga diobati dengan asam kromik untuk meningkatkan adhesi mereka pada logam, lukisan dan zat lainnya.
Larutan asam kromik sangat berbahaya bagi manusia dan sebagian besar hewan dan lingkungan. Untuk alasan ini, proses cairan atau padatan limbah di mana asam kromik digunakan diperlakukan untuk menghilangkan krom (vi) tetap ada atau untuk memulihkan semua asam krom krom saat ini dan meregenerasi untuk menggunakannya kembali.
[TOC]
Struktur
Molekul asam kromik h2Cro4 Itu dibentuk oleh cromato cro ion42- dan dua ion hidrogen h+ Bersatu dengan ini. Dalam ion kromat, elemen kromium dalam keadaan oksidasi +6.
Struktur spasial ion kromat adalah tetrahedral, di mana kromium berada di tengah dan oksigen menempati empat simpul tetrahedron.
Dalam atom hidrogen asam kromik masing -masing di sebelah oksigen. Dari empat ikatan kromium dengan atom oksigen, dua ganda dan dua sederhana, karena mereka memiliki hidrogen yang disatukan untuk mereka.
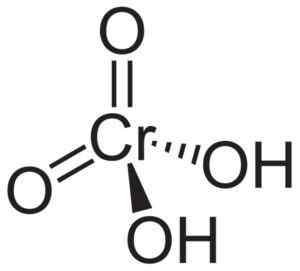 Struktur asam kromik h2Cro4 di mana bentuk kromat tetrahedral dan ikatan rangkap diamati. Neuroteker [domain publik]. Sumber: Wikipedia Commons.
Struktur asam kromik h2Cro4 di mana bentuk kromat tetrahedral dan ikatan rangkap diamati. Neuroteker [domain publik]. Sumber: Wikipedia Commons. Di sisi lain, oksida cro -croomic3 Ini memiliki atom chrome oksidasi yang dikelilingi oleh hanya tiga atom oksigen.
Tata nama
- Asam Cromic H2Cro4
- Asam tetraoxochromic h2Cro4
- Cro oksida cromic (asam kromi anhidrat) CRO3
- Kromium trioksida (asam kromi anhidrat) CRO3
Properti
Keadaan fisik
Anhydro atau Asam Kromik Oksida Kromik adalah padatan kristal ungu menjadi merah
Berat molekul
Cro3: 118.01 g/mol
Titik lebur
Cro3: 196 ºC
Di atas titik lelehnya tidak stabil secara termal, kehilangan oksigen (dikurangi) untuk memberikan kromium oksida (III) CR2SALAH SATU3. Ini membusuk sekitar 250 ºC.
Kepadatan
Cro3: 1.67-2,82 g/cm3
Kelarutan
Cro3 Ini sangat larut dalam air: 169 g/100 g air pada 25 ºC.
Itu larut dalam asam mineral seperti sulfat dan nitrat. Alkohol larut.
Properti lainnya
Cro3 Ini sangat higroskopis, kristalnya lezat.
Saat CRO3 Larutan dalam air membentuk larutan yang sangat asam.
Dapat melayani Anda: titanium: sejarah, struktur, sifat, reaksi, penggunaanIni adalah oksidan yang sangat kuat. Oxy bahan organik yang kuat di hampir semua bentuknya. Menyerang kain, kulit, dan beberapa plastik. Kebanyakan logam juga menyerang.
Sangat beracun dan sangat menjengkelkan karena potensinya yang tinggi.
Kimia larutan berair di mana asam kromik hadir
Oksida cromic3 Itu larut dengan cepat ke dalam air. Dalam larutan air krom (VI) dapat ada dalam bentuk ionik yang berbeda.
PH> 6,5 atau dalam larutan alkali chrome (vi) memperoleh bentuk ion cromato42- kuning.
Jika pH menurun (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , yang dapat dimerisasi menjadi ion dicromato cr2SALAH SATU72-, Dan solusinya menjadi oranye. Pada pH antara 2,5 dan 5,5 spesies dominan adalah hcro4- dan cr2SALAH SATU72-.
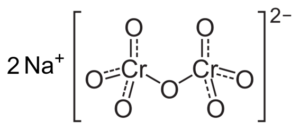 Struktur ion cr cr2SALAH SATU72- yang berada di sebelah dua ion na -na+. CAPACIO [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikipedia Commons.
Struktur ion cr cr2SALAH SATU72- yang berada di sebelah dua ion na -na+. CAPACIO [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikipedia Commons. Saldo yang terjadi dalam solusi ini ketika pH turun adalah sebagai berikut:
Cro42- (ion kromat) + h+ ⇔ hcro4-
Hcro4- + H+ ⇔ h2Cro4 (Asam Kromik)
2hcro4- ⇔ Cr2SALAH SATU72- (Ion dicromate) + h2SALAH SATU
Keseimbangan ini terjadi hanya jika asam yang ditambahkan untuk menurunkan pH3 atau hclo4, karena dengan asam lain, senyawa yang berbeda terbentuk.
Larutan asam dikromat adalah agen pengoksidasi yang sangat energik. Tetapi dalam larutan alkali ion kromat jauh lebih sedikit oksidan.
Memperoleh
Menurut sumber yang dikonsultasikan, salah satu cara untuk mendapatkan oksida cro cromic3, Ini terdiri dari menambahkan asam sulfat ke larutan sodium atau kalium dikromat berair, membentuk endapan oranye merah.
 Asam terhidrasi atau kromik oksida cromic. Himstakan [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikipedia Commons.
Asam terhidrasi atau kromik oksida cromic. Himstakan [cc by-sa 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikipedia Commons. Asam Cromic H2Cro4 Ini ditemukan dalam larutan oksida kromik berair dalam medium asam.
Penggunaan asam kromik
Dalam oksidasi senyawa kimia
Karena kapasitasnya yang sangat mengoksidasi, asam kromik telah digunakan sejak lama dan berhasil mengoksidasi senyawa organik dan anorganik.
Di antara contoh -contoh yang tak terhitung banyaknya adalah berikut ini: Ini memungkinkan pengoksidasi alkohol primer menjadi aldehida dan ini menjadi asam karboksilat, alkohol sekunder akibat keton, toluena menjadi asam benzoat, etilbenzena hingga asetofenon, trifenilmetano hingga trifenilcarbinol, asam formik a -coice a -coic2, asam oksalat ke co2, Asam laktat ke asetaldehida dan CO2, Iman besi2+ Iman Iman besi3+, ion iodida ke yodium, dll.
Memungkinkan konversi nitro-comprehensive menjadi nitro-compounds, sulfida menjadi sulfon. Ini mengintervensi sintesis keton berdasarkan alkena, seperti teroksidasi alkena terhidroborasi menjadi keton.
Senyawa sangat tahan terhadap oksidan biasa, seperti oksigen atau2 atau hidrogen peroksida h2SALAH SATU2, Mereka dioksidasi oleh asam kromik. Ini adalah kasus bastesses heterosiklik tertentu.
Dalam proses anodisasi logam
Anodisasi asam kromik adalah perlakuan elektrokimia yang berlaku untuk aluminium untuk melindunginya selama bertahun -tahun dari oksidasi, korosi dan keausan.
Proses anodisasi melibatkan pembentukan elektrokimia lapisan aluminium oksida atau alumina pada logam. Lapisan ini kemudian disegel dalam air panas, yang dicapai dengan konversi menjadi trihidrasi aluminium oksida.
Lapisan oksida yang disegel tebal, tetapi secara struktural lemah dan tidak terlalu memuaskan untuk serikat perekat berikutnya. Namun, dengan menambahkan sejumlah kecil asam kromik ke dalam air penyegelan, permukaan dikembangkan yang dapat membentuk ikatan yang baik.
Dapat melayani Anda: hukum tentang konservasi materiAsam kromik dalam air penyegel melarutkan bagian dari struktur sel tipe tebal dan meninggalkan tipis, kuat, melekat dengan kuat pada aluminium oksida, yang menempel dan membentuk sendi yang kuat dan tahan lama.
Anodisasi dengan asam kromik juga berlaku untuk titanium dan paduannya.
Dalam perawatan konversi kimia
Asam kromik digunakan dalam proses pelapisan logam dengan konversi kimia.
Selama proses ini, logam terendam dalam larutan asam kromik. Ini bereaksi dan melarutkan sebagian permukaan yang mengendap pada saat yang sama lapisan tipis senyawa kromium kompleks yang berinteraksi dengan logam dasar.
Proses ini disebut pelapisan konversi chromat atau chrome konversi.
Logam yang umumnya mengalami konversi krom adalah berbagai jenis baja, seperti baja karbon, baja tahan karat dan baja dilapisi seng, dan beberapa logam non -jantan, seperti paduan magnesium, paduan timah, paduan aluminium, tembaga, kadmium, mangan dan perak.
Perawatan ini memberikan korosi dan ketahanan kecerahan terhadap logam. PH yang lebih tinggi dari proses resistensi yang lebih besar terhadap korosi. Suhu mempercepat reaksi asam.
Lapisan berbagai warna dapat diterapkan, seperti biru, hitam, emas, kuning dan transparan. Ini juga memberikan kepatuhan yang lebih baik dari permukaan logam terhadap lukisan dan perekat.
Di permukaan yang terkikis atau dicincang
Larutan asam kromik digunakan dalam persiapan permukaan material termoplastik, polimer termosistem dan elastomer untuk lapisan selanjutnya dengan lukisan atau perekat.
H2Cro4 mencapai efek pada kimia permukaan dan strukturnya, karena membantu meningkatkan kekasarannya. Kombinasi gigitan dan oksidasi meningkatkan penetrasi perekat dan bahkan dapat menyebabkan perubahan sifat polimer.
Ini telah digunakan untuk mengikis polietilen bercabang dengan kepadatan rendah, kepadatan tinggi dan polietilen linier polypropylene.
Ini banyak digunakan dalam industri yang dapat diterima elektro atau galvanoplasti untuk memfasilitasi adhesi logam-polimer.
Dalam beberapa kegunaan
Asam kromik digunakan sebagai pengawet kayu, juga dalam bahan magnetik dan untuk katalisis reaksi kimia.
Pemulihan asam cromic
Ada banyak proses yang menggunakan asam kromik dan menghasilkan arus atau residu yang mengandung krom (iii) yang tidak dapat dibuang karena mereka memiliki ion krom (vi) yang sangat beracun, atau digunakan kembali karena konsentrasi ion kromat sangat rendah.
Disposisi membutuhkan pengurangan kimia kromat menjadi kromium (III), diikuti oleh hydroxide dan presipitasi filtrasi, yang menghasilkan biaya tambahan.
Untuk alasan ini, berbagai metode telah dipelajari untuk menghapus dan memulihkan kromat. Inilah beberapa di antaranya.
Melalui penggunaan resin
Selama bertahun -tahun, resin pertukaran ion untuk pengolahan air yang terkontaminasi kromat telah digunakan. Ini adalah salah satu perawatan yang disetujui oleh Badan Perlindungan Lingkungan AS, atau EPA (akronim untuk bahasa Inggris Badan Perlindungan Lingkungan).
Metode ini memungkinkan pemulihan asam kromik terkonsentrasi karena diregenerasi lagi dari resin.
Resin bisa menjadi basis yang kuat atau lemah. Dalam resin yang sangat mendasar, kromat dapat dihapus sebagai ion HCRO4- dan cr2SALAH SATU72- Mereka ditukar dengan ion OH- dan Cl-. Dalam resin dasar yang lemah, misalnya sulfat, ion dipertukarkan dengan SOS42-.
Dapat melayani Anda: nepelometriDalam kasus resin yang sangat dasar R- (OH), reaksi global adalah sebagai berikut:
2roh + hcro4- + H+ ⇔ r2Cro4 + 2h2SALAH SATU
R2Cro4 + 2hcro4- ⇔ 2RHCRO4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2SALAH SATU7 + H2SALAH SATU
Untuk setiap mol R2Cro4 Mengubah satu mol Cr (VI) dari larutan dihilangkan, yang membuat metode ini sangat menarik.
Setelah menghilangkan kromat, resin diperlakukan dengan larutan yang sangat basa untuk meregenerasi mereka di tempat yang aman. Kemudian kromat dikonversi menjadi asam kromik terkonsentrasi untuk digunakan kembali.
Melalui regenerasi elektrokimia
Metode lain adalah regenerasi elektrokimia asam kromik, yang juga merupakan alternatif yang sangat nyaman. Melalui prosedur ini, krom (III) dioksidasi secara oksidasi menjadi krom (VI). Bahan anoda dalam kasus ini lebih disukai timbal dioksida.
Penggunaan mikroorganisme untuk membersihkan limbah dengan sisa asam kromik
Metode yang telah diselidiki dan masih dalam penelitian adalah penggunaan mikroorganisme yang ada secara alami dalam limbah tertentu yang terkontaminasi dengan ion krom heksavalen yang merupakan isi dalam larutan asam kromik.
 Limbah berbahaya bagi lingkungan. Penulis: OpenClipart-Vektor. Sumber: Pixabay.
Limbah berbahaya bagi lingkungan. Penulis: OpenClipart-Vektor. Sumber: Pixabay. Bakteri bakteri tertentu yang ada di perairan air limbah penyamakan. Mikroba ini telah dipelajari dan ditentukan bahwa mereka resisten terhadap kromat dan juga dapat mengurangi krom (vi) menjadi krom (iii) yang jauh lebih tidak berbahaya bagi lingkungan dan makhluk hidup.
Untuk alasan ini, diperkirakan bahwa mereka dapat digunakan sebagai metode ramah lingkungan untuk remediasi dan detoksifikasi limbah yang terkontaminasi dengan sisa asam kromik.
Risiko asam kromik dan oksida kromi
Cro3 Itu bukan bahan bakar tetapi dapat mengintensifkan pembakaran zat lain. Banyak reaksi Anda dapat menyebabkan kebakaran atau ledakan.
Cro3 dan larutan asam kromik adalah kulit iritasi yang kuat (mereka dapat menyebabkan dermatitis), mata (dapat membakarnya) dan selaput lendir (dapat menyebabkan bronkasma) dan dapat menyebabkan "lubang krom" yang disebut SO di sistem pernapasan.
Senyawa krom (VI) seperti asam kromik dan oksida kromik sangat toksik, mutagenik dan karsinogenik untuk sebagian besar makhluk hidup.
Referensi
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Asam Kromik. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wegman, r.F. dan Van Twisk, J. (2013). Paduan aluminium dan aluminium. 2.5. Proses anodize asam kromik. Dalam teknik persiapan permukaan untuk ikatan perekat (edisi kedua). Pulih dari scientedirect.com.
- Wegman, r.F. dan Van Twisk, J. (2013). Magnesium. 6.4. Persiapan paduan magnesium dan magnesium oleh proses pengolahan asam kromik. Dalam teknik persiapan permukaan untuk ikatan perekat (edisi kedua). Pulih dari scientedirect.com.
- Grot, w. (2011). Aplikasi. 5.1.8. Regenerasi Asam Kromik. Dalam ionomer berfluorinasi (edisi kedua). Pulih dari scientedirect.com.
- Swift, k.G. dan Booker, J.D. (2013). Proses rekayasa permukaan. 9.7. Kromasi. Dalam Buku Pegangan Pemilihan Proses Pabrikan. Pulih dari scientedirect.com.
- Poulson, a.H.C. et al. (2019). Teknik modifikasi permukaan mengintip, termasuk perlakuan permukaan plasma. sebelas.3.2.1. Etsa permukaan. In Peek Biomaterials Handbook (Edisi Kedua). Pulih dari scientedirect.com.
- Westheimer, f.H. (1949). Mekanisme oksidasi asam kromik. Ulasan Kimia 1949, 45, 3, 419-451. Pulih dari pub.ACS.org.
- Tan, h.K.S. (1999). Remival asam kromik dengan pertukaran anion. The Canadian Journal of Chemical Engineering, Volume 77, Februari 1999. Diperoleh dari perpustakaan online.Wiley.com.
- Kabir, m.M. et al. (2018). Isolasi dan karakterisi bakteri pengurangan kromium (VI) dari limbah penyamakan kulit dan limbah padat. Jurnal Dunia Mikrobiologi dan Bioteknologi (2018) 34: 126. NCBI pulih.Nlm.Nih.Pemerintah.
- « Karakteristik, elemen, dan contoh lanskap industri
- Struktur molekul asam cyanhydric, sifat, penggunaan »

