Apa itu disulfurik apa itu, struktur, sifat, penggunaan
- 3690
- 695
- Miss Wm Hudson
Apa itu asam disulfuric?
Dia asam disulfuri Ini adalah salah satu dari banyak sulfur oxoacids, yang formula kimianya h2S2SALAH SATU7. Rumus ini secara eksplisit menunjukkan bahwa ada dua atom belerang, dan seperti namanya juga menunjukkan, harus ada dua molekul H2Sw4 hanya satu; Namun, ada tujuh oksigen, bukan delapan, jadi belerang harus memiliki tiga.
Asam ini adalah salah satu komponen utama minyak (atau asam sulfat asap), yang menjadi bentuk asam sulfat "padat". Begitulah dominasi mereka, yang beberapa orang menganggap minyak sebagai sinonim untuk asam disulfuri; yang juga dikenal dengan nama tradisional asam pirosulfuri.
Pada gambar penerima dengan minyak ditampilkan, dengan konsentrasi sulfur trioksida, jadi3, 20 %. Zat ini ditandai dengan berminyak dan tidak berwarna; Meskipun kekuningan atau coklat bisa menjadi kuning tergantung pada konsentrasi SO3 dan kehadiran beberapa kotoran.
Hal di atas menceritakan partisipasi SO3 dalam h2S2SALAH SATU7; yaitu molekul H2Sw4 Bereaksi dengan salah satu dari begitu3 Untuk membentuk asam disulfuri. Berada saat itu, h2S2SALAH SATU7 Itu juga bisa ditulis sebagai h2Sw4· SW3.
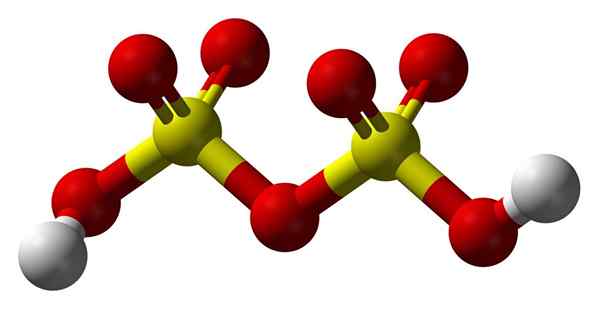
Struktur asam disulfuri
 Struktur asam disulfuri
Struktur asam disulfuri Ke atas2S2SALAH SATU7 Dalam model bola dan bar. Perhatikan simetri molekul: sisi kiri jembatan oksigen identik dengan kanan. Dari perspektif itu, struktur dapat dijelaskan dengan rumus HO3Hambar3H.
Di kedua ujungnya adalah masing -masing gugus hidroksil, yang hidrogennya, dengan efek induktif dari semua atom oksigen tersebut, meningkatkan beban parsial positif; Dan akibatnya, asam disulfuri bahkan memiliki keasaman yang lebih kuat dari asam sulfat.
Dapat melayani Anda: kalium hidroksida: struktur, sifat, penggunaanMolekul dapat ditulis sebagai h2Sw4· SW3. Namun, ini lebih mengacu pada komposisi oleum daripada struktur molekul.
Namun, jika molekul air ditambahkan ke h2S2SALAH SATU7, Dua molekul H akan dilepaskan2Sw4:
H2S2SALAH SATU7 + H2Atau 2H2Sw4
Keseimbangan dapat bergerak ke kiri: ke pembentukan h2S2SALAH SATU7 Dari h2Sw4 Jika panas disediakan. Karena alasan inilah untuk h2S2SALAH SATU7 Ia juga dikenal sebagai asam pirosulfuri; karena dapat dihasilkan setelah pemanasan asam sulfat.
Juga, sebagaimana disebutkan di awal, h2S2SALAH SATU7 Itu dibentuk oleh kombinasi langsung h2Sw4 Dan sebagainya3:
Sw3 + H2Sw4 H2S2SALAH SATU7
Properti
 Oleum. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)], melalui Wikimedia Commons
Oleum. Sumber: w. Oelen [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)], melalui Wikimedia Commons Sifat asam disulfuri tidak ditentukan dengan baik, karena sangat sulit untuk diisolasi murni dari minyak.
Harus diingat bahwa mungkin ada senyawa lain dalam minyak, dengan h h2Sw4· Xso3, di mana tergantung pada nilai x bahkan dapat memiliki struktur polimer.
Salah satu cara untuk memvisualisasikannya adalah dengan membayangkan bahwa struktur atas h2S2SALAH SATU7 menjadi lebih memanjang dengan lebih banyak unit dari SO3 dan jembatan oksigen.
Dalam keadaan hampir murni itu terdiri dari padatan kristal yang tidak stabil (merokok) yang meleleh pada 36ºC. Namun, titik leleh ini dapat bervariasi tergantung pada komposisi yang sebenarnya.
Asam disulfuri dapat membentuk apa yang dikenal sebagai garam disulfat (atau pyrosulfate). Misalnya, jika Anda bereaksi dengan kalium hidroksida, bentuk kalium pyrosulfate, k2S2SALAH SATU7.
Selain itu, dapat dikomentari bahwa ia memiliki berat molekul 178 g/mol, dan dua ekuivalen asam (2 jam ion+ yang dapat dinetralkan dengan basis yang kuat).
Dapat melayani Anda: volatilisasiReaksi dehidrasi gula
Dengan senyawa berbentuk minyak ini, reaksi yang aneh dapat dilakukan: transformasi benjolan blok karbon.
H2S2SALAH SATU7 Ini bereaksi dengan gula yang menghilangkan semua kelompok OH dalam bentuk air, yang mendukung serikat baru di antara atom karbon; serikat pekerja yang akhirnya menyebabkan batu bara hitam.
Tata nama
Asam disulfuri dianggap sebagai anhidrida asam sulfat; Yaitu, kehilangan produk molekul air dari kondensasi antara dua molekul asam. Sebelum begitu banyak nama yang mungkin untuk senyawa ini, nomenklatur IUPAC hanya merekomendasikan bahwa asam disulfuric.
Istilah 'piro' menyinggung secara eksklusif yang dibentuk sebagai produk dari aplikasi panas. IUPAC tidak menyarankan nama ini untuk h2S2SALAH SATU7; Tetapi saat ini masih digunakan oleh banyak ahli kimia.
Pengakhiran -ICO tetap tidak berubah -ubah karena atom belerang terus mempertahankan valensi +6. Misalnya, dapat dihitung dengan operasi aritmatika berikut:
2h + 2s + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Aplikasi
Menyimpan asam sulfat
Asam disulfuri, diberikan propertinya untuk memadat sebagai minyak, mampu melarutkan dan menyimpan asam sulfat lebih aman. Ini karena begitu3 melarikan diri menciptakan "kabut" yang tidak diserahkan, yang jauh lebih larut dalam h2Sw4 daripada di air. Untuk mendapatkan h2Sw4, Itu akan cukup untuk menambah minyak air:
H2S2SALAH SATU7 + H2Atau 2H2Sw4
Sintesis asam sulfat 100%
Dari persamaan sebelumnya, h2Sw4 Itu diencerkan di air yang ditambahkan. Misalnya, jika Anda memiliki larutan h berair H2Sw4, Dimana begitu3 Ia cenderung melarikan diri dan mewakili risiko bagi pekerja, menambahkan minyak ke larutan ini bereaksi dengan air yang membentuk lebih banyak asam sulfat; yaitu, meningkatkan konsentrasinya.
Itu dapat melayani Anda: ketidakpercayaan bahan kimiaJika ada air yang tersisa, lebih dari itu ditambahkan3, yang bereaksi dengan h2Sw4 Untuk menghasilkan lebih banyak asam disulfuri atau minyak, dan kemudian melembabkan lagi "mengeringkan" h2Sw4. Prosesnya mengulangi cukup terkadang mendapatkan asam sulfat pada konsentrasi 100%.
Proses serupa digunakan untuk mendapatkan asam nitrat 100%. Demikian juga, telah digunakan untuk mendehidrasi zat kimia lainnya, digunakan untuk elaborasi bahan peledak.
Sulfonasi
Struktur, seperti pewarna; yaitu, tambahkan grup -jadi3H, yang kehilangan proton asam Anda dapat berlabuh ke polimer serat tekstil.
Di sisi lain, keasaman oleum digunakan untuk mencapai nitrasi kedua (tambahkan grup -tidak2) ke cincin aromatik.
Referensi
- Kimia anorganik. (edisi keempat). MC Graw Hill.
- Asam Pyrosulfuric. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- « 20 penemuan kebangkitan yang mengubah dunia
- Bakteri Breaking Apa itu, karakteristik dan persiapan »

