Asam Sulfat (H2SO4)

- 3802
- 463
- Joseph Nader PhD
Kami menjelaskan apa asam sulfat, struktur kimianya, sifatnya, bagaimana ia diperoleh, aplikasi dan risiko penggunaan
 Perahu asam sulfat (H2SO4)
Perahu asam sulfat (H2SO4) Apa itu asam sulfat?
Dia asam sulfat, Juga disebut hidrogen sulfat dan minyak vitriol, itu adalah asam sulfur oksasid yang dibentuk oleh reaksi anhidrida sulfat (jadi3) dan air. Formula molekulnya adalah H2Sw4 Dan sejauh ini, itu adalah asam mineral yang paling banyak diproduksi dan digunakan.
Ini adalah asam mineral yang kuat dan sangat korosif yang dapat disembuhkan dengan air sehingga dapat disiapkan dalam bentuk larutan hampir semua konsentrasi antara 0 dan sekitar 18 molar.
Tingginya volume produksi dan konsumsi senyawa ini disebabkan oleh banyak aplikasi dalam industri yang bervariasi seperti pertanian, industri petrokimia, dalam sintesis organik dan anorganik dan dalam pengolahan air limbah, untuk menyebutkan hanya beberapa beberapa beberapa.
Struktur asam sulfat
Asam sulfat dibentuk oleh atom sulfur sentral dengan Valencia VI yang dikelilingi oleh 4 atom oksigen, dua di antaranya terkait dengan atom hidrogen. Struktur Lewis -nya disajikan di bawah ini:
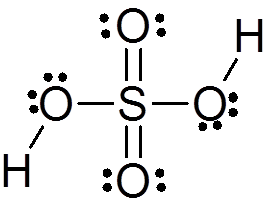
Seperti yang Anda lihat, belerang dalam senyawa ini dikelilingi oleh 12 elektron (6 pasangan), sehingga mewakili salah satu pengecualian dari aturan oktet.
Dikelilingi oleh 4 atom, teori tolakan pasangan elektron Valencia (Trepev) memprediksi bahwa senyawa ini harus mengasumsikan geometri tetrahedral yang kira -kira, yang ditunjukkan pada gambar berikut:
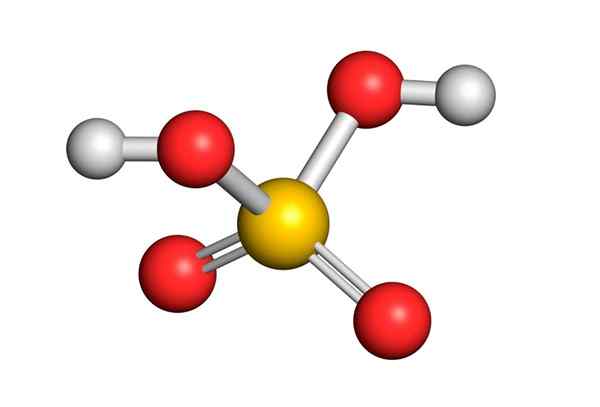
Karena elektronegativitas oksigen yang tinggi dan struktur resonansi yang berbeda yang dapat dimiliki asam sulfat, ikatan antara oksigen dan hidrogen sangat terpolarisasi, yang membuatnya sangat asam dan mudah untuk memisahkan hidrogen.
Sifat asam sulfat
Sebagai konsekuensi dari strukturnya, asam sulfat memiliki sifat fisik dan kimia berikut:
Ini dapat melayani Anda: Epoxide: Nomenklatur, Perolehan, Aplikasi, ContohProperti fisik
- Asam sulfat murni adalah cairan tak berwarna dan toilet yang memiliki kepadatan 1.8302 g/ml.
- Titik lelehnya adalah 10,31 ° C dan perebusan adalah 337 ° C, meskipun pada suhu itu cenderung terurai untuk menghasilkan air dan anhidrida sulfat (juga disebut belerang trioksida).
- Ini benar -benar larut dengan air, sehingga Anda dapat menyiapkan solusi dengan konsentrasi apa pun. Namun, larutan dengan lebih dari 98,3% massa asam ini tidak stabil dan asam terurai sampai konsentrasinya menurun menjadi 98,3%. Larutan ini stabil dan apa yang dikenal sebagai asam sulfat pekat.
- Dalam keadaan murni atau terkonsentrasi, itu adalah cairan yang lebih kental daripada air.
Sifat kimia
- Asam sulfat murni adalah zat oksidan dan korosif yang kuat. Ini memiliki kemampuan untuk mengoksidasi, dehidrat dan sulfonar ke berbagai senyawa organik dan karbonisasi lainnya.
- Ini adalah asam diprotik yang kuat yang benar -benar kehilangan proton pertamanya dengan melarutkan air sehingga menjadi basa terkonjugasi, ion bisulfat (HSO4-). Ion ini juga asam, meskipun lebih lemah dari asam asli.
- Larutan asam sulfat berair sangat asam dan mampu melarutkan banyak logam, menghasilkan hidrogen gas. Mereka juga dapat sepenuhnya menetralkan basis yang kuat.
- Bereaksi keras dengan banyak alkohol dan air, melepaskan sejumlah besar panas dalam prosesnya.
Bagaimana asam sulfat diperoleh?
Tiga proses produksi asam sulfat paling terkenal adalah: proses kontak, proses asam sulfat basah dan proses kamera timbal.
1. Sintesis asam sulfat dengan proses kontak
Ini adalah metode yang paling banyak digunakan saat ini untuk menghasilkan asam sulfat. Proses ini terdiri dari 5 langkah di mana sulfur dasar menjadi belerang dioksida (jadi2), lalu sulfur trioksida (jadi3), asam disulfuri (h2S2SALAH SATU7) dan, akhirnya, dalam asam sulfat. Reaksi yang terlibat adalah:
Dapat melayani Anda: apa itu belah ketupat keamanan dan untuk apa?
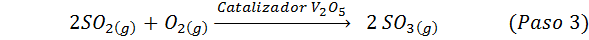


Langkah kedua dari proses ini hanya terdiri dari pemurnian sulfur dioksida sebelum dikonversi menjadi sulfur atau sulfat anhidrida trioksida. Reaksi langkah ketiga terjadi ketika sulfur dioksida gas bersentuhan dengan katalis vanadium pentaoksida padat (V2SALAH SATU5), Dan itulah sebabnya metode ini disebut proses kontak.
2. Sintesis asam sulfat oleh proses basah
Proses ini dirancang untuk memurnikan gas emisi dari berbagai industri dan pabrik kimia. Produk sampingan dari pemurnian ini adalah asam sulfat kelas komersial selain uap air panas, yang dapat digunakan kembali dalam proses industri asli.
Dalam kasus proses basah, reaksinya sebagian besar. Reaksi penting yang terjadi pada setiap tahap adalah:
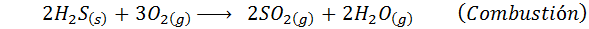
3. Sintesis asam sulfat dengan proses kamera timbal
Ini adalah metode kuno untuk menghasilkan asam sulfat yang digunakan saat ini sangat sedikit. Prosesnya adalah untuk membakar belerang dasar di hadapan oksigen udara di ruang kayu yang dilapisi timbal, dan karenanya namanya.
Setelah pembakaran ini, sulfur dioksida kemudian bereaksi dengan nitrogen oksida yang dihasilkan oleh dekomposisi natrium nitrat atau dengan cara lain. Pada akhirnya, setelah serangkaian reaksi tambahan, asam sulfat diperoleh.
Dapat melayani Anda: labu latar belakang datarAplikasi umum
- Aplikasi utama asam sulfat adalah sebagai sumber belerang dalam bentuk sulfat dalam pembuatan pupuk. Faktanya, sekitar 60% asam sulfat yang diproduksi di dunia dimaksudkan untuk tujuan ini.
- Dalam industri kimia digunakan untuk sintesis deterjen, pigmen, katalis untuk industri petrokimia dan dalam pemrosesan mineral untuk mendapatkan logam yang berbeda.
- Akhirnya, asam sulfat adalah elektrolit yang digunakan dalam baterai timbal yang digunakan di sebagian besar mobil.
Risiko yang terkait dengan asam sulfat
Karena sifat kimianya, asam sulfat bisa sangat berbahaya bagi manusia dan hewan dan lingkungan secara umum. Ini adalah beberapa risiko yang terkait dengan bahan kimia ini:
- Karakteristik korosif dan dehidrasi membuat asam murni menyebabkan kerusakan besar jika bersentuhan dengan kulit.
- Di sisi lain, reaksi larutan asam sulfat dengan logam menghasilkan hidrogen gas, yang merupakan bahan bakar dan bahan peledak.
- Asam sulfat itu sendiri tidak menderita reaksi pembakaran, tetapi, menjadi oksidan yang kuat, merangsang pembakaran zat lain, bertindak sebagai semacam katalis, sehingga merupakan risiko kebakaran yang cukup besar.
- Selain itu, ketika terpapar api, itu dapat dipecah menjadi gas beracun dan menghasilkan uap asam sulfat yang dapat dengan mudah menghancurkan saluran udara.
Untuk alasan ini dan lebih banyak lagi, asam sulfat adalah zat yang harus ditangani dengan cermat.