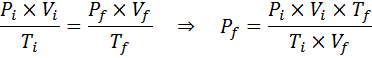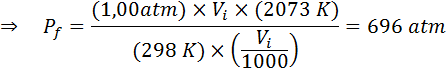Hukum Gas Umum

- 893
- 119
- Miss Wm Hudson
Apa hukum gas umum?
Itu Hukum Gas Umum, Terkadang juga disebut Gabungan Hukum Gas, itu adalah kombinasi Hukum Boyle, Charles dan Gay-Lussac. Ini adalah undang -undang yang menggambarkan hubungan antara tekanan, suhu dan volume jumlah tetap dari gas ideal.
Pernyataan hukum ini mengatakan:
“Jika jumlah mol gas adalah konstan, hubungan antara volume tekanan dan produk suhu tetap konstan."
Dalam bentuk matematika, hukum umum gas dinyatakan sebagai berikut:
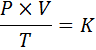
Di mana P mewakili tekanan gas, v volumenya, t suhu absolutnya, dan k adalah konstanta proporsionalitas, yang nilainya tergantung pada jumlah gas saat ini dan unit di mana variabel lain diekspresikan.
Bentuk alternatif hukum gas umum
Sebagai hukum proporsionalitas
Cara alternatif untuk mengucilkan hukum umum gas adalah dalam bentuk hukum proporsionalitas:
"Untuk jumlah gas tetap, produk tekanannya dan volumenya berbanding lurus dengan suhu".
Ini berarti bahwa:
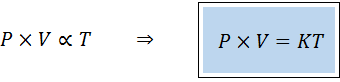
Ini setara dengan mengalikan kedua anggota persamaan pertama berdasarkan suhu.
Hubungan antara keadaan awal dan akhir
Seperti hukum Boyle, Charles dan Gay-Lussac, undang-undang gas umum dapat dinyatakan sebagai hubungan antara negara awal dan keadaan akhir gas yang mengalami perubahan negara bagian.
Berbeda dengan undang -undang sebelumnya, tidak perlu bahwa tidak satu pun dari tiga variabel tetap konstan, hanya jumlah tahi lalat. Artinya rasio PXV/T akan sama dalam keadaan awal, yo, Dan di negara bagian terakhir, F. Dengan kata lain, hukum gas umum juga dapat dinyatakan secara matematis sebagai:
Itu dapat melayani Anda: asam píchrat: apa itu, struktur, sintesis, sifat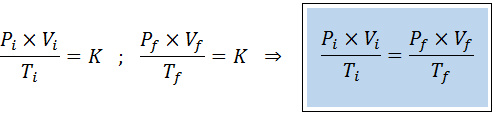
Derivasi formula hukum gas umum
Seperti disebutkan di atas, hukum gas umum berasal dari kombinasi Hukum Boyle, Charles dan Gay-Lussac. Undang -undang ini disajikan di bawah ini:
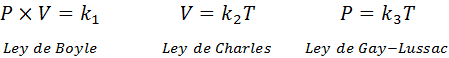
Jika dari masing -masing undang -undang ini kita membersihkan konstan k, Dan kemudian kami melipatgandakannya satu sama lain, kami mendapatkan:
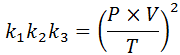
Sekarang, mengambil akar kuadrat di kedua anggota, hukum gas umum diperoleh:
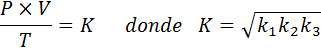
Hukum Umum Gas VS. Hukum Gas Ideal
Undang -undang gas umum dengan hukum gas ideal tidak boleh bingung. Meskipun dua undang-undang yang sangat mirip dan terkait erat, undang-undang gas umum hanya menggabungkan hukum Boyle, Charles dan Gay-Lussac.
Untuk bagiannya, undang -undang gas ideal menambahkan prinsip avogadro, menurutnya "Volume yang sama dari gas yang berbeda diukur dalam suhu dan kondisi tekanan yang sama, mengandung jumlah partikel yang sama ”.
Sebagai akibatnya, selain menghubungkan suhu, volume dan tekanan, hukum gas ideal juga memungkinkan variabel -variabel ini terkait dengan jumlah partikel atau tahi lalat gas, sehingga mewakili persamaan keadaan status status tersebut Gas ideal.
Dalam persamaan berikut, perbedaan antara kedua undang -undang ini dapat diamati dengan lebih mudah:

Perhatikan bahwa perbedaan utama antara kedua undang -undang adalah bahwa hukum Gase yang ideal termasuk N, yang mewakili jumlah tahi lalat, dan juga bukan konstanta K, Have Konstan r yang merupakan konstan dari gas ideal.
Dapat melayani Anda: terpenosKita dapat mengatakan bahwa undang -undang gas ideal lebih umum daripada hukum gas umum, karena dapat diterapkan untuk jumlah gas berapa pun di bawah segala kondisi tekanan, suhu dan volume. Di sisi lain, penerapan hukum gas umum mensyaratkan bahwa jumlah gas tetap konstan.
Contoh Penerapan Hukum Gas Umum
Di bawah ini adalah beberapa contoh masalah khas di mana hukum gas umum dapat diterapkan:
Contoh 1: gelembung udara bawah air
Misalkan penyelam yang berada pada kedalaman 20 m di bawah air di mana tekanannya 3,00 atm dan suhunya 15 ° C melepaskan napas udara dan salah satu gelembung memiliki volume awal 100 cm3.
Tentukan volume gelembung udara saat mencapai permukaan yang berada dalam kondisi suhu dan tekanan standar, dengan asumsi bahwa jumlah udara di dalam gelembung tidak berubah saat naik.
Larutan
Pertama, kita harus mengekstrak semua data dari pernyataan itu. Dapat dipahami bahwa ada dua negara bagian yang berbeda untuk gas, satu awal dan satu ujung, jadi kami memisahkan data menjadi dua kelompok. Juga perlu untuk mengonversi suhu pada suhu absolut:

Seperti yang ditentukan masalah bahwa tidak ada perubahan dalam jumlah gas (udara) maka kita dapat menerapkan hukum gas umum, dari mana kita dapat menghapus volume akhir:
Dapat melayani Anda: rodio: sejarah, sifat, struktur, penggunaan, risiko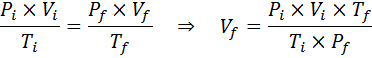
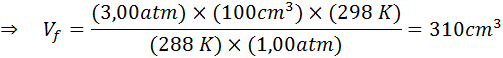
Oleh karena itu, gelembung udara mencapai volume 310 cm3 Setelah mencapai permukaan.
Contoh 2: Tekanan Tinggi
Berapa tekanan gas ideal yang pada suhu sekitar 25 ° C dan tekanan 1,00 atm dan kompres keseribu volumenya pada saat yang sama panas hingga 1800 ° C dalam wadah yang disegel?
Larutan
Seperti sebelumnya, kita mulai dengan mengekstraksi data:

Seperti yang dikatakan bahwa proses dilakukan dalam wadah tertutup, maka jumlah gas tidak berubah, sehingga hukum gas umum dapat diterapkan: