Struktur, sifat dan penggunaan asam yodhydric (HI)

- 3200
- 55
- Irvin Reichel
Dia Asam Iarhydric Ini adalah larutan air hidrogen iodida yang ditandai dengan keasamannya yang tinggi. Definisi yang lebih melekat pada terminologi kimia dan IUPAC, adalah bahwa itu adalah hidrasinya, yang formulanya kimianya HI.
Namun, untuk membedakannya dari molekul gas hidrogen iodida, hi (g), itu dilambangkan sebagai HI (AC). Karena alasan inilah dalam persamaan kimia penting untuk mengidentifikasi lingkungan atau fase fisik di mana reagen dan produk telah. Meski begitu, kebingungan antara hidrogen iodida dan asam iarchloric biasanya umum.
 Ion asam iarhidric. Sumber: Gabriel Bolívar.
Ion asam iarhidric. Sumber: Gabriel Bolívar. Jika molekul yang berkomitmen diamati dalam identitasnya, perbedaan terkenal antara Hi (g) dan HI (AC) akan ditemukan. Di HI (G), ada tautan H-I; Saat berada di HI (AC), mereka sebenarnya adalah sepasang ion i- dan H3SALAH SATU+ berinteraksi secara elektrostátic (gambar superior).
Di sisi lain, HI (AC) adalah sumber Hi (g), karena yang pertama disiapkan oleh pembubaran yang kedua dalam air. Karena itu, kecuali dalam persamaan kimia, HI juga dapat digunakan untuk juga merujuk pada asam iarchydric. Hi adalah agen pereduksi yang kuat dan sumber ion yang sangat baik i- Dalam media berair.
[TOC]
Struktur Asam Yodhydric
Asam Yodhydric, seperti yang dijelaskan, terdiri dari larutan HI dalam air. Berada di dalam air, molekul hi disosiasi sepenuhnya (elektrolit kuat), yang berasal dari ion i- dan H3SALAH SATU+. Disosiasi ini dapat diwakili dengan persamaan kimia berikut:
Hai (g) + h2Atau (l) => i-(Ac) + h3SALAH SATU+(AC)
Apa yang setara jika ditulis sebagai:
Hai (g) + h2Atau (l) => hai (ac)
Namun, HI (AC) tidak mengungkapkan sama sekali apa yang terjadi pada molekul HI gas; Itu hanya menunjukkan bahwa mereka berada dalam media berair.
Oleh karena itu, struktur Hi (AC) yang sebenarnya terdiri dari ion i- dan H3SALAH SATU+ Dikelilingi oleh molekul air yang melembabkannya; Semakin banyak asam iarhydric, semakin rendah jumlah molekul air tanpa proton.
Dapat melayani Anda: Hukum BoyleSecara komersial, pada kenyataannya, konsentrasi HI adalah 48 hingga 57% dalam air; Lebih terkonsentrasi akan setara dengan asam yang terlalu merokok (dan bahkan lebih berbahaya).
Pada gambar, dapat dilihat bahwa anion i- Itu diwakili dengan bola ungu, dan h3SALAH SATU+ Dengan bola putih dan merah, untuk atom oksigen. Kation h3SALAH SATU+ Menyajikan piramida trigonal geometri molekuler (terlihat dari bidang yang lebih tinggi dalam gambar).
Properti
Deskripsi Fisik
Cairan tidak berwarna; Tapi, Anda dapat menunjukkan nada kekuningan dan coklat jika Anda berhubungan langsung dengan oksigen. Ini karena ion i- Mereka akhirnya mengoksidasi yodium molekul, saya2. Jika ada banyak saya2, Kemungkinan besar bahwa triaduro anion akan dibentuk, saya3-, yang menodai solusinya seperti coklat.
Massa molekul
127.91 g/mol.
Bau
Hektar.
Kepadatan
Kepadatannya adalah 1,70 g/ml untuk solusi HI 57%; Sejak itu, kepadatan bervariasi tergantung pada konsentrasi HI yang berbeda. Konsentrasi ini membentuk azeotropik (disuling sebagai zat tunggal dan bukan sebagai campuran) yang stabilitas relatifnya mungkin berutang komersialisasi di atas solusi lainnya.
Titik didih
57% HI azeotrope mendidih pada 127ºC pada tekanan 1,03 bar (lulus ke ATM).
PKA
-1.78.
Keasaman
Ini adalah asam yang sangat kuat, sehingga sangat korosif untuk semua logam dan jaringan; bahkan untuk karet.
Ini karena tautan H-I sangat lemah, dan mudah rusak selama ionisasi airnya. Selain itu, jembatan hidrogen i- - Hoh2+ Mereka lemah, jadi tidak ada yang mengganggu h3SALAH SATU+ bereaksi dengan senyawa lain; itu, h3SALAH SATU+ memiliki "gratis", seperti i- Itu tidak menarik terlalu banyak ke balasannya.
Dapat melayani Anda: pycnometerAgen pereduksi
Hi adalah agen pereduksi yang kuat, yang produk reaksi utamanya adalah i2.
Tata nama
Nomenklatur asam iarhydric berasal dari fakta bahwa yodium "bekerja" dengan keadaan oksidasi tunggal: -1. Dan di samping itu, namanya menunjukkan bahwa ia memiliki air dalam formula strukturalnya [i-] [H3SALAH SATU+]. Ini satu -satunya namanya, karena itu bukan senyawa murni tetapi larutan.
Aplikasi
Sumber yodium dalam sintesis organik dan anorganik
Hi adalah sumber ion yang sangat baik i- Untuk sintesis anorganik dan organik, dan juga merupakan agen pereduksi yang kuat. Misalnya, pembubaran airnya yang 57% digunakan untuk sintesis alkil iodida (seperti CHO3Ch2I) dari alkohol primer. Demikian juga, grup OH dapat menggantikan dalam struktur dengan i.
Agen pereduksi
Asam Yodhydric telah digunakan untuk mengurangi, misalnya, karbohidrat. Jika glukosa dilarutkan dalam asam ini dipanaskan, ia akan kehilangan semua gugus OH, memperoleh sebagai produk hidrokarbon N-heksana.
Demikian juga, ini telah digunakan untuk mengurangi kelompok fungsional lembaran graphene, sehingga dapat difungsikan untuk perangkat elektronik.
Proses Cativa
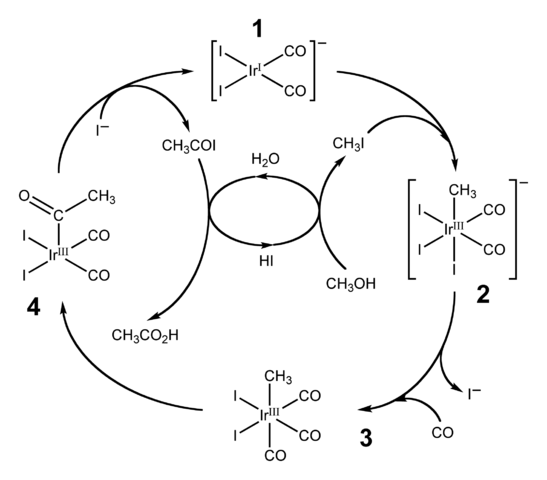 Diagram siklus katalitik untuk proses Cativa. Sumber: Ben Mills [Domain Domain Publik].HI juga digunakan untuk produksi industri asam asetat melalui proses CATIVA. Ini terdiri dari siklus katalitik di mana metanol karbonililasi terjadi; yaitu, ke molekul ch3OH kelompok karbonil diperkenalkan, c = o, untuk berubah menjadi asam cho3Cooh.
Diagram siklus katalitik untuk proses Cativa. Sumber: Ben Mills [Domain Domain Publik].HI juga digunakan untuk produksi industri asam asetat melalui proses CATIVA. Ini terdiri dari siklus katalitik di mana metanol karbonililasi terjadi; yaitu, ke molekul ch3OH kelompok karbonil diperkenalkan, c = o, untuk berubah menjadi asam cho3Cooh.
Langkah
Proses dimulai (1) dengan kompleks organo-iridium [IR (CO)2yo2]-, geometri datar persegi. Senyawa ini "menerima" metil iodida, ch3I, produk dari pengasaman cho3Oh dengan 57% hai. Air juga terjadi dalam reaksi ini, dan berkat asam asetat diperoleh pada akhirnya, sementara memungkinkan HI untuk pulih pada langkah terakhir.
Dapat melayani Anda: koloidPada langkah ini kedua grup -ch3 Saat -i bergabung dengan Ididio Metal Center (2), membentuk kompleks oktahedral dengan segi yang terdiri dari tiga ligan dan. Salah satu Yodos akhirnya menggantikan dirinya dengan molekul karbon monoksida, CO; Dan sekarang (3), kompleks oktahedral memiliki segi yang terdiri dari tiga co -ligands.
Kemudian penataan ulang terjadi: grup -ch3 Ini "dirilis" dari IR dan bergabung dengan yang berdekatan (4) untuk membentuk kelompok asetil, -coch3. Grup ini dirilis dari kompleks Iridido untuk menautkan ke ion iodida dan memberi Cho3COI, asetil iodida. Di sini katalis iridium ditemukan, siap untuk berpartisipasi dalam siklus katalitik lain.
Akhirnya, Cho3COI menderita pengganti I- Untuk molekul H2Atau, yang mekanismenanya berakhir dengan melepaskan HI dan asam asetat.
Sintesis ilegal
 Reaksi reduksi efedrin dengan fosfor dan fosfor merah hingga metafetamin. Sumber: methamphetamine_from_ephedrine_with_hi_ru.SVG: Turunan Ring0 Trabajo: MaterialScientist (Speaking) [Domain Publik].Asam Yodhydric telah digunakan untuk sintesis zat psikotropika mengambil keuntungan dari kekuatan reduktif yang tinggi. Misalnya, Anda dapat mengurangi efedrin (obat untuk pengobatan asma) dengan adanya fosfor merah, menjadi metamfetamin (gambar superior).
Reaksi reduksi efedrin dengan fosfor dan fosfor merah hingga metafetamin. Sumber: methamphetamine_from_ephedrine_with_hi_ru.SVG: Turunan Ring0 Trabajo: MaterialScientist (Speaking) [Domain Publik].Asam Yodhydric telah digunakan untuk sintesis zat psikotropika mengambil keuntungan dari kekuatan reduktif yang tinggi. Misalnya, Anda dapat mengurangi efedrin (obat untuk pengobatan asma) dengan adanya fosfor merah, menjadi metamfetamin (gambar superior).
Dapat dilihat bahwa penggantian kelompok OH oleh I, diikuti dengan penggantian kedua untuk H.
Referensi
- Wikipedia. (2019). Asam Hidroiodik. Diperoleh dari: di.Wikipedia.org
- Andrews, Natalie. (24 April 2017). Penggunaan asam hidriodik. Ilmu pengetahuan. Pulih dari: ilmuwan.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Asam hidriodik. Pulih dari: alfa.com
- Pusat Nasional Informasi Bioteknologi. (2019). Asam hidriodik. Database pubchem., CID = 24841. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Steven a. Hardinger. (2017). Ilustrasi Daftar Kimia Organik: Asam Hidroiodik. Pulih dari: chem.UCLA.Edu
- Reusch William. (05 Mei 2013). Karbohidrat. Pulih dari: 2.Kimia.MSU.Edu
- Di Kyu Moon, Junghyun Lee, Rodney S. Ruoff & Hyoyoung Lee. (2010). Reded traphene oxide dengan grafitisasi kimia. Doi: 10.1038/ncomms1067.
- « Karakteristik, jenis dan contoh pembelajaran memoristik
- Karakteristik, jenis, kelebihan dan tahapan bioproses »

