Perbedaan asam dan basa, karakteristik, contoh
- 2824
- 274
- Miss Wm Hudson
Itu asam dan basa Mereka adalah senyawa kimia yang tidak menyajikan satu definisi tunggal, tetapi beberapa, yang bergantung pada karakteristik atau sifat yang dipertimbangkan. Secara umum, dapat dikatakan bahwa asam adalah zat asam, sedangkan basa adalah saponáceas atau sabun.
Definisi terpenting, seperti Brönsted-Lowry, atau Arrhenius, lebih fokus pada pelepasan ion H3SALAH SATU+ (Hydronium) U oh-(hidroksil) oleh zat -zat ini. Baik dalam bentuk murni atau terlarut dalam air.
Definisi yang muncul sebagai konsekuensi dari hal -hal di atas adalah sebagai berikut: asam yang dilarutkan dalam air menghasilkan larutan dengan nilai pH lebih kecil dari 7, sedangkan basa terlarut menghasilkan larutan dengan nilai pH lebih besar dari 7. PH justru merupakan cara untuk mengekspresikan seberapa asam atau basa adalah cairan dengan mempertimbangkan konsentrasi h3SALAH SATU+.
Oleh karena itu, zat asam, seperti jus jeruk, memiliki pH kurang dari 7 dan banyak ion H3SALAH SATU+. Sedangkan pangkalan, seperti Legía, memiliki pH lebih besar dari 7 dan banyak ion OH-.
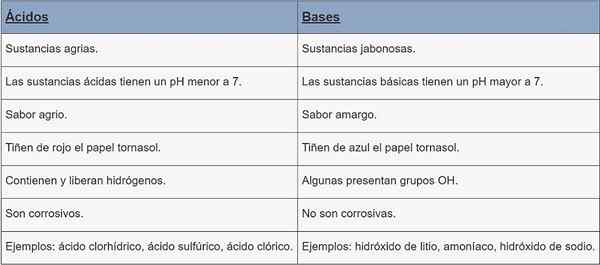
Asam | Pangkalan | |
Jenis zat | Zat agraria. | Zat Jabonesas. |
ph | pH kurang dari 7. | ph lebih besar dari 7. |
Rasa | Kecut. | Pahit. |
Pewarnaan | Kertas DAS Merah. | Pewarna kertas tepung jagung biru. |
Karakteristik | Mereka mengandung dan melepaskan hidrogen. | Beberapa kelompok oh hadir. |
Korosi | Mereka korosif. | Mereka tidak korosif. |
Contoh | Asam klorida, asam sulfat, asam klorat. | Lithium hidroksida, amonia, natrium hidroksida. |
Asam
 Jus jeruk adalah salah satu perwakilan asam paling terkenal dari kehidupan kita sehari -hari
Jus jeruk adalah salah satu perwakilan asam paling terkenal dari kehidupan kita sehari -hari Karakteristik asam
Zat asam memiliki karakteristik tertentu:
Rasa asam
Asam memiliki rasa asam. Secara rutin, jenis rasa ditetapkan dengan istilah 'asam'. Dengan demikian, dikatakan bahwa jus lemon dan cairan beberapa permen karet adalah asam, karena rasanya asam dan kuat untuk langit -langit mulut.
Kertas DAS Merah
Asam adalah zat yang mampu mengubah warna kertas semprot biru menjadi merah. Shortasol adalah bagian dari serangkaian zat yang dapat mengubah warna tergantung pada tingkat keasaman atau kebesaran lingkungan di mana mereka ditemukan. Zat -zat ini disebut indikator pH.
Dapat melayani Anda: sifat solusi koligatifMereka mengandung dan melepaskan hidrogen
Asam adalah senyawa kimia yang memiliki elemen kimia hidrogen (H), yang memberikan karakteristik keasamannya.
Banyak zat lain juga mengandung hidrogen, tetapi mereka tidak dapat melepaskannya seperti yang terjadi dengan asam. Saat membebaskan, hidrogen dalam bentuk ion atau kation+. Ini h+, Saat memenuhi molekul air, mereka ditambahkan ke ini untuk membentuk ion H3SALAH SATU+.
Mereka mengangkut arus listrik
Karena atom H+ yang dilepaskan saat asam dalam air dilarutkan, ini dapat mengangkut listrik melalui penggunaan baterai atau baterai.
Mereka korosif
Ada asam kuat yang sangat korosif. Oleh karena itu, kontak dengan mereka harus dihindari, karena mereka dapat menyebabkan kerusakan fisik yang parah. Bahkan asam lemah, pada konsentrasi yang sangat tinggi, seperti asetat (cuka) dapat membakar kulit dan faring jika uapnya bernafas.
Kuat dan lemah
Asam kuat menghasilkan konsentrasi ion H yang besar3SALAH SATU+ Saat mereka larut dalam air. Dikatakan bahwa atom hidrogen asam kuat mudah dipisahkan. Sementara itu, asam lemah melepaskan beberapa atom hidrogen dan, oleh karena itu, menghasilkan konsentrasi ion H yang lebih rendah3SALAH SATU+.
Asam kuat memiliki pH yang sangat rendah, yang tergantung pada konsentrasi dan kekuatan asam, bisa 1 atau kurang. Sebaliknya, asam lemah memiliki pH asam yang lebih tinggi, yang dapat misalnya 4 atau 5.
Asam kuat memiliki bau yang menghasilkan sensasi terbakar. Sementara itu, asam lemah tidak menyajikan jenis penciuman ini, bahkan dalam beberapa kasus mereka memiliki bau yang menyenangkan. Namun, ada banyak pengecualian, jadi mereka tidak disarankan untuk mencium bau asam lemah bahkan.
Dapat melayani Anda: besi oksida (iii): struktur, nomenklatur, sifat, penggunaanAsam kuat adalah transporter listrik yang baik. Sebaliknya, asam lemah adalah konduktor listrik yang buruk dengan melepaskan beberapa atom H+.
Asam kuat mampu menyerang logam, seperti seng, membentuk sejumlah besar gelembung hidrogen. Reaksi ini tidak dihasilkan oleh asam lemah.
Contoh asam
Asam kuat
-HCl: asam klorida
-H2Sw4: asam sulfat
-HBR: Asam Bromydric
-Hai: Asam Yodhydric
-Hno3: asam sendawa
-Hclo4: asam perklorat
-Hclo3: Asam klorat
Asam lemah
-Ch3COOH: asam asetat
-Hno2: Asam nitrat
-H2BERSAMA3: Asam karbonat
-H3PO4: Asam fosfat
-C3H5O (COOH): Asam sitrat
-HF: asam fluorhidric
-H2Sw3: Asam belerang
Pangkalan
 Amonia adalah zat dasar
Amonia adalah zat dasar Karakteristik dasar
Basis menyajikan karakteristik berikut:
-Mereka menghasilkan sensasi sabun atau sabun di jari, menyebabkan benda -benda diambil oleh tangan menjadi licin.
-Mereka memiliki selera yang pahit.
-Mereka dapat bereaksi dengan asam, menghasilkan pembentukan senyawa yang disebut garam. Dalam beberapa kasus, ini dapat mengendap atau tenggelam ke dalam air. Juga, dalam reaksi basa dengan asam, air terbentuk.
-Mereka mengubah warna kertas kecambah biru, menunjukkan bahwa solusinya memiliki pH lebih besar dari 7 atau alkali.
-Beberapa pangkalan hadir dalam kelompok formula kimianya, yang disebut hidroksi, yang dibentuk oleh atom hidrogen dan atom oksigen.
Kuat dan lemah
Basis yang kuat adalah senyawa kimia yang menghadirkan satu atau lebih kelompok OH dalam struktur kimianya, yang ketika mereka bersentuhan dengan air memperoleh beban negatif, oh-.
Sementara itu, basis yang lemah tidak ada dalam kelompok hidroksil formula kimianya. Namun, basis lemah saat bereaksi dengan air juga menghasilkan ion atau anion oh-.
Basis yang kuat, seperti natrium hidroksida, memiliki nilai pH yang sangat tinggi, mendekati 14. Sementara itu, basis lemah memiliki pH yang lebih rendah, seperti amonia, yang memiliki pH 11.
Dapat melayani Anda: mendidih: konsep, jenis dan contohBasis yang kuat digunakan di rumah untuk mengungkap saluran air. Begitulah kasus kalium hidroksida. Sementara itu, basis lemah digunakan dalam pekerjaan pembersihan, seperti amonia yang ada di banyak pembersih.
Contoh pangkalan
Pangkalan yang kuat
-Lioh: lithium hidroksida
-NaOH: natrium hidroksida
-KOH: Kalium hidroksida
-RBOH: Rubidio Hydroxide
-CSOH: Cesium hidroksida
-Sr (oh)2: Strontium hidroksida
-Ba (oh)2: barium hidroksida
Basis yang lemah
-NH3: amonia
-Nhet2: Diethylamine
-NH2Ch3: Metilamine
-C5H5N: Pyridine
Perbedaan antara asam dan basa
Ion rilis itu
Asam melepaskan atom H+ atau h3SALAH SATU+ Saat mereka larut dalam air. Sementara itu, pangkalan melepaskan atau menghasilkan kontak dengan ion air oh-.
Nilai pH
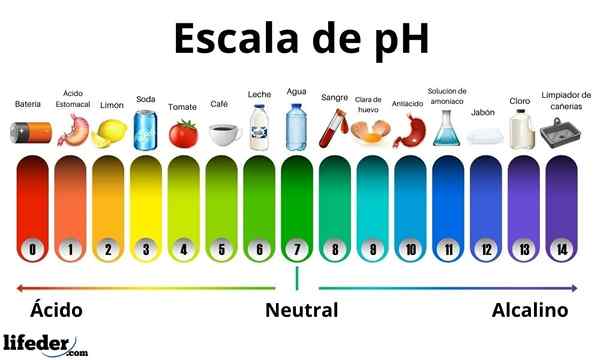
Asam memiliki nilai pH antara 0 dan 7. Sementara itu, pangkalan memiliki nilai pH antara 7 dan 14. Oleh karena itu, asam memutar warna kertas kecambah dan basa memutarnya dengan warna biru.
Reaksi pelatihan
Asam berasal dari reaksi unsur non -metalik oksida, misalnya klorin, sulfur, dll., Dengan air, atau mereka juga terbentuk ketika hidrogen dikombinasikan dengan elemen non -metalik dan kemudian senyawa yang terbentuk larut dalam air (HF, HCL, HBR, dll.).
Basis diproduksi oleh reaksi oksida dari logam, misalnya besi, tembaga, magnesium, dll., Dengan air. Harus diingat bahwa oksida adalah kombinasi atom oksigen dengan elemen kimia lainnya.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Definisi dan contoh asam. Pulih dari: thinkco.com
- Penjelajah Sains. (31 Juli 2018). Mengajar anak -anak tentang asam dan basa. Dipulihkan dari: Pengeksplor Sains.com
- Penyusunan contoh. (2013). Karakteristik asam. Pulih dari: teladan.com
- Kimia Lumen untuk Non-Mayor. (S.F.). Sifat asam dan basa. Pulih dari: kursus.Lumenarning.com
- Clark Jim. (2013). Basis yang kuat dan lemah. Pulih dari: chemguide.bersama.Inggris
- « Flora dan fauna spesies perwakilan Sierra Ekuador
- Kerangka Metodologis Cara Menulisnya, Struktur, Contoh »

