Sodium klorit (NaClo2) Struktur, sifat, penggunaan, risiko

- 4846
- 1413
- Dewey Runolfsdottir
Dia Sodium Klorit Ini adalah padatan anorganik yang dibentuk oleh ion natrium na+ dan clo ion klorit2-. Formula kimianya adalah naclo2. Ini adalah padatan putih kristal, selain menjadi zat pengoksidasi yang kuat. Oleh karena itu, itu harus sangat berhati -hati.
Penggunaan utamanya adalah sebagai agen desinfektan untuk banyak aplikasi. Ini memungkinkan untuk menghilangkan mikroba pada permukaan seperti lantai, dinding dan peralatan laboratorium di rumah sakit dan klinik dan di sistem air mereka.
 Sodium klorit naclo2 padat. Penulis: ChemicalInterest . Sumber: Wikimedia Commons.
Sodium klorit naclo2 padat. Penulis: ChemicalInterest . Sumber: Wikimedia Commons. Juga di fasilitas pertanian dan veteriner, untuk menghiasi inkubator telur burung, untuk mengendalikan infeksi sapi perah, untuk mendisinfeksi sistem air untuk hewan, dll.
Dalam industri makanan, larutan air mereka yang diasamkan berfungsi untuk mencuci daging, ayam, buah -buahan, sayuran, serta peralatan fasilitas tersebut.
Dengan natrium klorit, klorin dioksida dapat disiapkan2 Di situs penggunaan, yang memungkinkan Anda untuk menghilangkan mikroba, bau buruk dan rasa air sehingga menyenangkan dan dapat minum tanpa masalah.
Ini juga berfungsi untuk memutihkan bubur kertas, serat tekstil sayuran dan minyak, di antara aplikasi lainnya.
Naclo2 Padatan harus ditangani dengan hati -hati, karena kontak dengan ledakan bahan tertentu dapat terjadi. Solusi mereka sedikit lebih mudah untuk dimanipulasi tetapi mereka sangat mengoksidasi dan korosif.
[TOC]
Struktur
Natrium klorit terdiri dari kation natrium+ dan clo klorit anion2- Oleh karena itu mereka dipersatukan oleh ikatan ionik.
Anion klorit memiliki atom klorin dalam keadaan oksidasi +3 dan dua atom oksigen dengan valencia -2 masing -masing. Karena alasan ini anion klorit memiliki beban negatif.
Itu juga memiliki struktur berbentuk sudut.
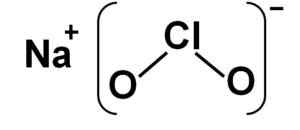 Struktur Naclo Sodium Klorit2. Penulis: Marilú Stea.
Struktur Naclo Sodium Klorit2. Penulis: Marilú Stea. Tata nama
- Sodium Klorit
- Sodium Klorit
- Garam natrium kloro
Properti
Keadaan fisik
Solid putih kristal.
Berat molekul
90.44 g/mol.
Titik lebur
Itu terurai saat meleleh antara 180 dan 200 ºC.
Kepadatan
2.468 g/cm3
Kelarutan
Air larut: 64 g/100 g air pada 17 ºC. Sedikit larut dalam metanol.
Properti lainnya
Itu sedikit higroskopis.
Itu adalah agen pengoksidasi yang kuat. Bereaksi dengan keras dengan bahan yang mudah terbakar dan peredam. Bereaksi dengan keras dengan asam, menghasilkan klorin dioksida2.
Dapat melayani Anda: aturan hume-rotheryLarutan alkali (artinya dengan adanya NaOH) cukup stabil, sedangkan dalam medium asam HCLO asam kloro terbentuk2, yang membusuk dengan cepat:
4 hclo2 → 2 clo2↑ + clo3- + Cl- + 2 h+ + H2SALAH SATU
Risiko
Keduanya naclo2 Solid karena solusi air mereka berpotensi berbahaya dan membutuhkan banyak kehati -hatian dan pengalaman selama manipulasi dan penyimpanan mereka.
Naclo2 Padatan bisa meledak saat bersentuhan dengan zat organik termasuk sarung tangan dan pakaian, bahan tumpahan -kontrol seperti serbuk gergaji dan limbah kapas, serta minyak dan lemak.
Oleh karena itu bentuk padat sangat sulit diangkut dan lebih disukai menggunakannya dalam bentuk larutan air.
Solusi ini sangat korosif. Mereka sebaiknya menjaga pH di atas 8, yaitu, pH alkali.
Naclo2 mempercepat pembakaran senyawa atau bahan yang mudah terbakar, sampai pada titik yang dapat membentuk campuran eksplosif dengan ini.
Jika dipanaskan, emit asap beracun asam hidroklorat HCl dan natrium oksida NA2SALAH SATU. Jika diperpanjang berkepanjangan untuk panas atau api itu dapat dieksploitasi.
Memperoleh
Ini disiapkan dimulai dengan reduksi kimia atau elektrokimia sodio naclo3, Di hadapan asam klorida HCl untuk menghasilkan klorin dioksida2.
Yang terakhir bereaksi dengan hidrogen peroksida h2SALAH SATU2 Dalam larutan berair naOH natrium hidroksida dan larutan natrium natrium klorit diperoleh2, yang menguap dan mengkristal padatan.
Itu juga dapat diperoleh dengan melewati gas klorin dioksida2 Untuk solusi NaOH.
2 clo2 + 2 NaOH → Naclo2 + Naclo3 + H2SALAH SATU
Aplikasi
Sebagai mikrobisida dan desinfektan dalam banyak aplikasi
Ini adalah bahan dari banyak produk yang berfungsi untuk mengendalikan bakteri, jamur, dan lumpur atau lumpur ganggang. Produk yang mengandungnya untuk tujuan ini digunakan dalam pertanian, perdagangan, industri dan tempat tinggal atau rumah.
Itu berfungsi sebagai desinfektan dari banyak jenis bahan dan permukaan.
Di bidang pertanian, unggas dan industri serupa adalah permukaan keras yang didesinfeksi, peralatan, fasilitas untuk inkubasi telur burung, rumah kaca untuk jamur seperti jamur, dan sistem air pendingin dan air untuk pena burung burung.
Ini memiliki penggunaan hewan sebagai desinfektan topikal dalam kontrol mastitis sapi perah, untuk membenamkan puting hewan. Mastitis adalah infeksi sapi uders.
Dapat melayani Anda: Proses adiabatik: Jenis, contoh, latihan terpecahkan Terkadang Anda harus membenamkan sapi dalam larutan natrium klorit untuk menghindari infeksi di dalamnya. Penulis: Hans Braxmeier. Sumber: Pixabay.
Terkadang Anda harus membenamkan sapi dalam larutan natrium klorit untuk menghindari infeksi di dalamnya. Penulis: Hans Braxmeier. Sumber: Pixabay. Ini juga digunakan di perusahaan penelitian alami untuk mendekontaminasi laboratorium.
Penggunaan komersial, industri dan medis meliputi sistem ventilasi desinfeksi, permukaan yang keras (seperti lantai, dinding, peralatan laboratorium) dan sistem air.
Di fasilitas perawatan kesehatan seperti klinik dan rumah sakit itu digunakan untuk mendekontaminasi kamar, koridor, area isolasi dan sterilisasi material.
Ini juga berguna untuk melakukan higienisasi di perusahaan di mana orang menjalani perawatan air atau spa.
Di industri makanan digunakan sebagai fumigant untuk menghemat makanan.
Ini digunakan dalam bentuk natrium klorit yang diasamkan. Ini diproduksi dengan menambahkan asam grade makanan (misalnya, asam sitrat, asam fosfat, asam roda atau asam natrium sulfat) ke dalam larutan sodium klorit yang berair.
Sodium klorit yang diasamkan memiliki sifat antimikroba dan digunakan sebagai embun atau pencucian ayam atau larutan perendaman, daging, sayuran, buah -buahan dan produk laut. Juga dalam air untuk membekukan ayam atau burung.
Di rumah tangga memungkinkan untuk mendisinfeksi permukaan keras, seperti lantai dan kamar mandi, sistem pemanas atau pendingin udara dan sistem sirkulasi air kolam.
 Untuk mendisinfeksi kolam, Anda dapat menggunakan natrium klorit naclo2. Penulis: Grup Global Usia. Sumber: Pixabay.
Untuk mendisinfeksi kolam, Anda dapat menggunakan natrium klorit naclo2. Penulis: Grup Global Usia. Sumber: Pixabay.  Produk yang mengandung natrium klorit memungkinkan kamar mandi toilet. Penulis: Michal Jarmoluk. Sumber: Pixabay.
Produk yang mengandung natrium klorit memungkinkan kamar mandi toilet. Penulis: Michal Jarmoluk. Sumber: Pixabay. Itu juga dijual dalam sachet kecil bersama dengan senyawa lain untuk melepaskan gas dan kontrol bau di rumah.
Untuk mendisinfeksi air minum
Ini digunakan dalam pemurnian air untuk diminum, bertindak sebagai oksidan, meningkatkan rasa dan aroma air minum.
Sodium klorit banyak digunakan sebagai prekursor untuk generasi clo klorin dioksida2 yang berfungsi untuk mengolah air minum untuk konsumsi manusia, yaitu untuk menghilangkan mikroorganisme, bau dan rasa yang tidak menyenangkan dan dapat minum.
Untuk menghasilkan clo2 HCL dapat digunakan:
5 Naclo2 + 4 hcl → 4 clo2↑ + 5 NaCl + 2 H2SALAH SATU
Clo2 Ini adalah agen antimikroba dari oksidan aksi tinggi dan spektrum luas. Yaitu, bertindak melawan sejumlah besar mikroorganisme.
Itu dapat melayani Anda: kalium nitrit (kno2): struktur, sifat dan penggunaanMikroorganisme dinonaktifkan karena clo2 mengganggu enzim penting dari ini dan dengan protein membran sel. Ini juga memiliki keuntungan bahwa ia tidak menghasilkan senyawa organoklorin, yang beracun.
Ada dijual tablet natrium klorit dicampur dengan senyawa lain yang dilarutkan dalam air dan segera menghasilkan clo2 dengan cara yang terkontrol, sehingga mendisinfeksi air.
 Sodium klorit digunakan dengan senyawa lain untuk mendapatkan air minum yang siap minum. Penulis: Ulrike Leone. Sumber: Pixabay.
Sodium klorit digunakan dengan senyawa lain untuk mendapatkan air minum yang siap minum. Penulis: Ulrike Leone. Sumber: Pixabay. Masalah utama mengolah air untuk menghilangkan rasa dan berbau melalui clo2 Itu terdiri dari klorit dan garam klorik beracun dapat dibentuk selama pengobatan.
Untuk perawatan lensa kontak
Naclo2 Ini adalah komponen dari solusi yang digunakan untuk mendisinfeksi lensa kontak.
Kombinasi NaClo digunakan2 dan jejak (jumlah yang sangat kecil) hidrogen peroksida h2SALAH SATU2.
H2SALAH SATU2 Menstabilkan clo2 yang terbentuk dan kombinasi keduanya sangat efektif melawan bakteri, jamur dan ragi. Produk yang kemudian adalah natrium klorida, air dan oksigen, yang tidak berbahaya, yang berarti bahwa mereka tidak berbahaya bagi mata.
Saat lensa dikeluarkan dari solusi, NaClo2 residual terurai dengan cepat di nall dan o2. Residual peroksida tidak mengganggu mata. Oleh karena itu solusi ini sangat aman.
 Solusi untuk mendisinfeksi lensa kontak memiliki natrium klorit di antara bahan -bahannya. Penulis: Nieuw ~ Commonswiki. Sumber: Wikimedia Commons.
Solusi untuk mendisinfeksi lensa kontak memiliki natrium klorit di antara bahan -bahannya. Penulis: Nieuw ~ Commonswiki. Sumber: Wikimedia Commons. Dalam berbagai aplikasi
Sodium klorit digunakan untuk persiapan klorin dioksida2 untuk penggunaan segera dalam sejumlah besar aplikasi yang beberapa diperlakukan dalam paragraf sebelumnya.
Ini berfungsi untuk memutihkan bubur kayu, tekstil seperti kapas, serat tanaman, minyak yang dapat dimakan dan tidak dapat dimakan, lemak, pernis, pernis dan lilin.
Ini adalah komponen tetes mata dan beberapa solusi untuk mencuci oral.
Ini digunakan dalam industri pemrosesan kulit dan dalam agen elektroda logam (lapisan logam).
Referensi
- Williams, l. et al. (2019). Mikrobiologi, Perawatan dan Pemeliharaan Lensa. In Contact Lenses (Edisi Keenam). Pulih dari scientedirect.com.
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Sodium Klorit. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Abu -abu, n.F. (2014). Klorin dioksida. Proses teknologi. Dalam mikrobiologi penyakit yang ditularkan melalui air (edisi kedua). Pulih dari scientedirect.com.
- McKen, l. (2012). Pengantar foodradition dan sterilisasi medis. Klorin dioksida. Dalam efek sterilisasi pada plastik dan elastomer (edisi ketiga). Pulih dari scientedirect.com.
- Ortenberg, e. dan Telsch, b. (2003). Masalah rasa dan bau di air minum. Dalam Buku Pegangan Mikrobiologi Air dan Air Limbah. Pulih dari scientedirect.com.
- Karsa, d.R. (2007). Biosida. Klorin dioksida. Dalam Buku Pegangan untuk Membersihkan/Dekontaminasi Permukaan. Pulih dari scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Ensiklopedia Kimia Industri Ullmann. (1990). Edisi Kelima. Vch verlagsgellschaft mbh.

