Aluminium klorida (ALCL3)

- 2358
- 597
- Irvin Reichel
 Formula dan struktur aluminium klorida
Formula dan struktur aluminium klorida Apa itu aluminium klorida?
Dia Aluminium klorida Ini adalah senyawa kimia anorganik yang formulanya ALCL3. Ini disajikan sebagai debu padat atau putih, meskipun karena kontaminasi dengan besi klorida, dan kelembaban, itu bisa menjadi kuning. Ini terdiri dari asam Lewis, tetapi dalam keadaan tertentu itu juga berperilaku sebagai basa Lewis.
Meskipun aluminium sebagai logam dalam tabel periodik, ada ikatan kovalen antara aluminium dan klorin untuk membentuk aluminium klorida.
Ikatan kovalen ini dapat menjelaskan mengapa aluminium cair klorida adalah konduktor listrik yang buruk; Sedangkan garam cair dari senyawa lain, seperti natrium klorida, adalah konduktor listrik yang baik.
Aluminium klorida diproduksi oleh reaksi eksotermik antara aluminium dan klorin, atau hidrogen klorida, pada suhu antara 650 dan 750 ºC.
Aluminium klorida digunakan sebagai antitranspirant dan untuk memerangi keringat berlebihan. Salah satu turunannya digunakan sebagai agen koagulan dalam pengolahan air limbah industri, dan juga digunakan sebagai katalis utama dalam reaksi kimia industri ini.
Struktur aluminium klorida
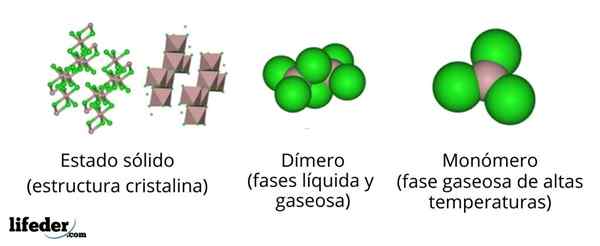
Pada gambar atas kami memiliki representasi yang berbeda untuk masing -masing struktur kristal atau molekul yang menunjukkan aluminium klorida anhidrat, ALCL3, Di beberapa keadaan fisiknya.
Alcl3 Padatan terdiri dari struktur kristal monoklinik yang dibentuk berdasarkan lapisan octaedros yang dikoordinasikan satu sama lain. Dalam octahedra ini (warna coklat), ion untuk3+ Itu terkoordinasi dengan enam ion CL-, Bertindak klorida sebagai jembatan antara dua octahedra.
Saat suhu meningkat dan alll didirikan3, Lapisan dipisahkan menjadi unit ke2Cl6 (Pusat Gambar). Sekarang, atom aluminium membentuk tautan dengan tiga atom klorin dan tautan dengan atom aluminium lainnya: CL3Al-alcl3. Dimer ini menjelaskan mengapa ALCL3 Cair kurang padat dari kristalnya.
Dapat melayani Anda: Gadolinio: Struktur, Properti, Memperoleh, PenggunaanDalam fase uap, dimer ke2Cl6 Mereka saling menjauhkan diri. Tetapi jika uap ini mengalami suhu tinggi, dimer terdisosiasi dalam unit molekul ALCL3, di mana atom aluminium membentuk tiga tautan dengan atom klorin. Alcl3 menyajikan geometri datar trigonal.
Sifat aluminium klorida
 Sampel padat aluminium klorida dengan nada kekuningan. Sumber: Xlollitox, CC oleh 3.0, via Wikimedia Commons
Sampel padat aluminium klorida dengan nada kekuningan. Sumber: Xlollitox, CC oleh 3.0, via Wikimedia Commons Rumus
Alcl3 (anhidrat)
Alcl3· 6h2O (hexahidrat)
Masa molar
133.34 g/mol (anhydro)
241.43 g/mol (hexahidrat)
Penampilan fisik
Debu padat atau putih kristal. Itu bisa menjadi rona kekuningan karena kontaminasi dengan besi klorida. Anda juga dapat berubah menjadi warna keabu -abuan untuk kelembaban.
Titik lebur
192.4 ºC
Titik didih
Sublima pada 178 ºC, jadi tidak mudah untuk mendapatkan titik didih aluminium klorida.
Kepadatan
2.48 g/cm3 (anhidrat)
2.398 g/cm3 (Hexahidrat)
Kelarutan air
439 g/l a 0 ºC
458 g/l pada 20 ºC
466 g/l A 30 ºC
Aluminium klorida adalah senyawa higroskopis yang dapat menyerap air udara basah, memancarkan asap selama proses.
Kelarutan dalam pelarut lain
Etanol larut, kloroform, karbon tetrachloride, benzofenon dan nitrobenzene. Sedikit larut dalam benzena.
Tekanan uap
13.3 kPa pada 151 ºC (0.131 atm).
Zat yang lengket dan kental
0.35 cp hingga 197 ºC
Reaktivitas
Aluminium klorida adalah zat amfotat, yaitu, berperilaku seperti asam atau basa. Namun, aksinya sebagai asam lebih dominan, karena aluminium klorida digunakan sebagai asam Lewis dan pada saat yang sama merupakan katalis dalam banyak reaksi kimia; Di antara mereka, reaksi Friedel-Crafts.
Dapat melayani Anda: neodymium: struktur, sifat, penggunaanBahkan aluminium klorida diklasifikasikan sebagai asam, bukannya melakukannya sebagai garam.
Anhidrat aluminium klorida dalam larutan berair diubah menjadi garam heksahidrat (ALCL3· 6h2O), yang tidak kembali ke bentuk anhidrat dengan pemanasan.
Atom aluminium dari dua molekul ALCL3 Mereka berinteraksi satu sama lain untuk menyelesaikan 8 elektron di lapisan valensi mereka, yang menghasilkan pembentukan dimer ke2Cl6. Dimer ini hadir dalam aluminium cair klorida dan uap.
Aluminium klorida bereaksi dengan natrium hidroksida untuk membentuk aluminium hidroksida, endapan gelatin:
Alcl3 + NaOH → Al (OH)3 + 3 NaCl
Aplikasi aluminium klorida
Antitranspirant dan antihemoragik
 Aluminium klorida adalah bagian dari bahan yang digunakan dalam formulasi beberapa deodoran. Sumber: TH145, CC BY-SA 2.0, via Wikimedia Commons
Aluminium klorida adalah bagian dari bahan yang digunakan dalam formulasi beberapa deodoran. Sumber: TH145, CC BY-SA 2.0, via Wikimedia Commons Aluminium klorida digunakan sebagai antitranspirant dalam deodoran pribadi, dan juga digunakan untuk mengendalikan keringat berlebihan (hiperhidrosis). Ini juga digunakan dalam formulasi untuk mengendalikan perdarahan kecil, seperti yang disajikan dalam perawatan gigi.
Pengolahan limbah
Aluminium klorida dalam bentuk PAC (polyalumin klorida), digunakan sebagai koagulan dalam pengolahan air limbah industri, karena kemampuannya untuk mengklarifikasi air dan lumpur dehidrat.
Katalisator
Aluminium klorida adalah salah satu katalis utama yang digunakan dalam industri ini, bertindak sebagai katalis dalam berbagai reaksi, termasuk Friedel-Crafts.
Dapat melayani Anda: Europium: Struktur, Properti, Memperoleh, PenggunaanAluminium klorida mengkatalisasi reaksi persiapan antraquinon, beberapa di antaranya digunakan dalam industri tekstil. Ada juga antraquinon yang memiliki sifat antibakteri, antiparasit, fungisida dan antivirus.
Aluminium klorida mengkatalisasi reaksi yang dihasilkan oleh dodecilbenzene, yang digunakan dalam produksi deterjen, dan etilbenzena, senyawa yang digunakan dalam pembuatan polystyrene, polimer yang digunakan dalam elaborasi plastik, resin dan karet.
Aluminium klorida juga digunakan sebagai katalis dalam reaksi yang merupakan bagian dari produksi bensin oktan tinggi. Demikian juga, mengkatalisasi proses retak minyak.
Risiko
Aluminium klorida adalah zat korosif dan kontaknya dapat menyebabkan iritasi dan cedera kulit dan mata, menghasilkan kerusakan mata.
Ketika larut dalam air, gas beracun dapat dilepaskan, seperti hidrogen klorida; Gas yang mampu menghirup iritasi hidung dan tenggorokan, mampu menyebabkan iritasi yang keras dan paru. Iritasi ini dapat menyebabkan akumulasi cairan di paru -paru (edema paru), yang berakhir dengan keadaan darurat medis.
Ini telah mencoba untuk membangun hubungan antara penyakit Alzheimer dan aluminium klorida; Meskipun hasil penelitian tidak konklusif.
Demikian juga, hubungan antara penggunaan deodoran yang mereka gunakan sebagai anti -transpirant dengan alll telah diselidiki3 dan kanker payudara. Penelitian belum dapat menunjukkan hubungan yang konklusif. Bagaimanapun, aluminium klorida memblokir pengoperasian sistem detoksifikasi alami organisme dan emisi panas, seperti keringat.
Referensi
- Wikipedia. (2021). Aluminium klorida. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi (2021). Aluminium klorida, ringkasan senyawa pubchem untuk CID 24012. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- NJ Health. (2008). Lembar Fakta Substansi Bahaya: Aluminium Chloride. [PDF]. Pulih dari: NJ.Pemerintah
- Britannica Encyclopaedia. (2021). Aluminium klorida. Dipulihkan dari: Britannica.com
- Elsevier b.V. (2021). Anthraquinones. Ilmiah. Diperoleh dari: Scientedirect.com
- John p. Cunha. (02 Mei 2020). Aluminium klorida topikal. Pulih dari: rxlist.com

