Struktur tembaga klorida (I) (CUCL), sifat, penggunaan
- 3829
- 991
- Mr. Darrell Streich
Dia Tembaga klorida (I) Ini adalah senyawa anorganik yang dibentuk oleh tembaga (Cu) dan klorin (CL). Formula kimianya adalah CUCL. Tembaga dalam senyawa ini memiliki valencia +1 dan klorin -1. Ini adalah padatan kristal putih yang ketika terpapar lama di udara memperoleh warna kehijauan karena oksidasi tembaga (I) menjadi tembaga (II).
Itu berperilaku sebagai asam Lewis yang membutuhkan elektron senyawa lain yang merupakan basa Lewis, yang membentuk aduk yang kompleks atau stabil. Salah satu senyawa ini adalah karbon monoksida (CO), sehingga kemampuan untuk bergabung di antara mereka digunakan secara industri untuk mengekstraksi CO dari minuman ringan.
 Tembaga klorida (I) (CUCL) dimurnikan. Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Tembaga klorida (I) (CUCL) dimurnikan. Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Ini memiliki sifat optik yang dapat digunakan dalam semikonduktor pemancar cahaya. Selain itu, nanocube CUCL memiliki potensi besar untuk digunakan di perangkat energi yang efisien.
Ini digunakan dalam seni kembang api karena bersentuhan dengan api menghasilkan lampu hijau kebiruan.
[TOC]
Struktur
CUCL dibentuk oleh ion Cuproso Cup+ dan Anion Chloride CL-. Konfigurasi elektronik ion Cu+ adalah:
1s2 2s2 2 p6 3S2 3p6 3d10 4s0
Dan itu karena tembaga kehilangan elektron lapisan 4S. Ion klorida memiliki konfigurasi:
1s2 2s2 2 p6 3S2 3p6
Dapat dilihat bahwa kedua ion memiliki lapisan elektronik lengkapnya.
Senyawa ini mengkristal dengan simetri kubik. Pada gambar di bawah ini, susunan atom dalam unit kristal diamati. Bola merah muda sesuai dengan bola tembaga dan hijau ke klorin.
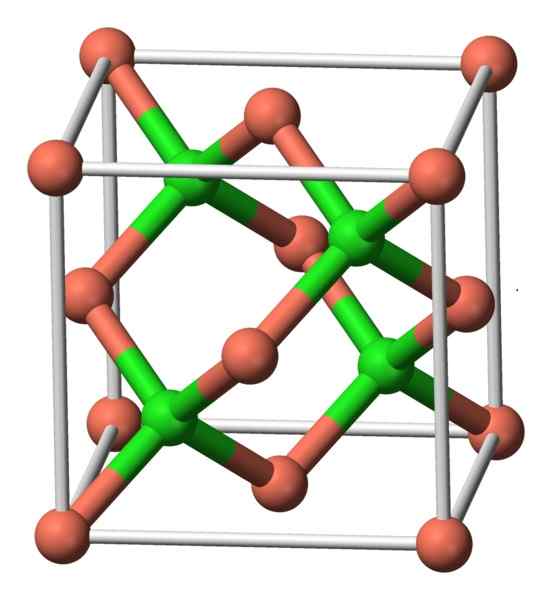 Struktur CUCL. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
Struktur CUCL. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Tata nama
- Tembaga klorida (I)
- Cuprous klorida
- Tembaga monoklorida
Properti
Keadaan fisik
Padatan putih kristal yang di udara berkepanjangan dengan udara teroksidasi dan berubah menjadi hijau.
Berat molekul
98.99 g/mol
Titik lebur
430 ºC
Titik didih
Sekitar 1400 ºC.
Kepadatan
4.137 g/cm3
Kelarutan
Hampir tidak larut dalam air: 0,0047 g/100 g air pada 20 ° C. Tidak larut dalam etanol (c2H5Oh) dan aseton (pilih3(C = o) ch3).
Itu dapat melayani Anda: Alilo: Unit Allyic, Carbocation, Radikal, ContohSifat kimia
Tidak stabil di udara karena Cu+ cenderung mengoksidasi cu2+. Seiring waktu, cupric oxide (CuO), cuprous hidroksida (CuOH) atau oksiklorida dan garam yang kompleks berubah hijau.
 Tembaga klorida (i) yang telah terpapar pada lingkungan dan sebagian teroksidasi. CuOH, CuOH dan senyawa lainnya mungkin mengandung. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons.
Tembaga klorida (i) yang telah terpapar pada lingkungan dan sebagian teroksidasi. CuOH, CuOH dan senyawa lainnya mungkin mengandung. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons. Dalam larutan berair juga tidak stabil karena reaksi oksidasi dan reduksi terjadi secara bersamaan, membentuk ion tembaga dan tembaga logam (II):
CUCL → Cu0 + CUCL2
CUCL sebagai asam Lewis
Senyawa ini bertindak secara kimiawi sebagai asam Lewis, yang berarti bahwa ia ingin elektron, sehingga membentuk aduk yang stabil dengan senyawa yang dapat memberikannya.
Ini sangat larut dalam asam klorida (HCl), di mana ion CL- Mereka berperilaku sebagai donor elektron dan spesies seperti CUCL terbentuk2-, CUCL32- dan cu2Cl42-, di antara yang lain.
 Ini adalah salah satu spesies yang terbentuk dalam larutan CUCL di HCl. Penulis: Marilú Stea.
Ini adalah salah satu spesies yang terbentuk dalam larutan CUCL di HCl. Penulis: Marilú Stea. Solusi CUCL berair memiliki kemampuan untuk menyerap karbon monoksida (CO). Penyerapan ini dapat terjadi ketika larutan ini bersifat asam dan netral atau dengan amonia (NH3).
Dalam solusi seperti itu diperkirakan bahwa berbagai spesies seperti Cu (CO) terbentuk+, Gila)3+, Gila)4+, CUCL (CO) dan [CU (CO) CL2]-, Yang tergantung pada mediumnya.
Properti lainnya
Ini memiliki karakteristik elektrooptic, kehilangan optik rendah dalam berbagai spektrum cahaya dari yang terlihat ke inframerah, indeks refraksi rendah dan dielektrik rendah konstan.
Memperoleh
Tembaga klorida (I) dapat diperoleh dengan bereaksi tembaga logam secara langsung dengan gas klor pada suhu 450-900 ° C. Reaksi ini berlaku secara industri.
2 cu + cl2 → 2 CUCL
Anda juga dapat menggunakan senyawa pereduksi seperti asam askorbat atau sulfur dioksida untuk melewati tembaga klorida (II) ke tembaga klorida (I). Misalnya, dalam kasus SO2, Ini teroksidasi menjadi asam sulfat.
2 CUCL2 + Sw2 + 2 h2O → 2 CUCL + H2Sw4 + 2 HCl
Aplikasi
Dalam proses pemulihan co
Kemampuan solusi penyerap dan insorber.
Dapat melayani Anda: turbidimetriMisalnya, proses yang disebut cosorb menggunakan tembaga klorida yang stabil dalam bentuk garam kompleks dengan aluminium (anycl4), yang larut dalam pelarut aromatik seperti toluena.
Solusi menyerap CO dari arus gas untuk memisahkannya dari gas lain seperti CO2, N2 dan ch4. Maka solusinya yang kaya monoksida dipanaskan di bawah tekanan tereduksi (yaitu, lebih rendah dari atmosfer) dan CO adalah exorg. Gas yang pulih dengan cara ini adalah kemurnian tinggi.
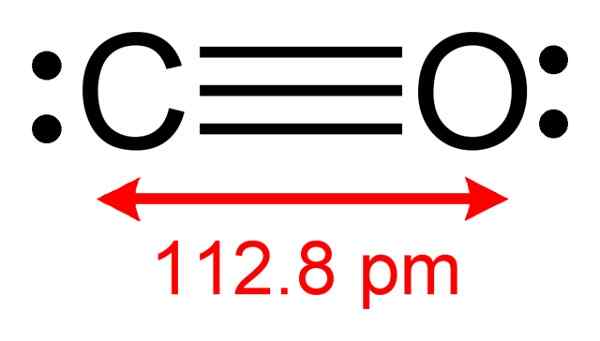 Struktur karbon monoksida di mana elektron tersedia untuk membentuk kompleks dengan CUCL diamati. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
Struktur karbon monoksida di mana elektron tersedia untuk membentuk kompleks dengan CUCL diamati. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Proses ini memungkinkan Anda untuk mendapatkan CO murni.
Pada katalisis
CUCL digunakan sebagai katalis untuk berbagai reaksi kimia.
Misalnya, reaksi elemen Germanio (GE) dengan hidrogen klorida (HCl) dan etilena (CH2= Ch2) dapat dilakukan dengan menggunakan senyawa ini. Ini juga berfungsi untuk sintesis senyawa silikon organik dan berbagai turunan organik heterosiklik sulfur dan nitrogen.
Anda dapat mensintesis polifenileneter polimer menggunakan sistem katalitik 4-amipirin dan jongkok dan jongkok. Polimer ini sangat berguna untuk sifat mekaniknya, sedikit penyerapan kelembaban, isolasi listrik yang sangat baik dan hambatan api.
Dalam memperoleh senyawa tembaga organik
Senyawa Alkenilcupratato dapat disiapkan dengan bereaksi terminal alka.
Dalam memperoleh polimer bersatu dengan logam
Tembaga klorida (I) dapat dikoordinasikan dengan polimer yang membentuk molekul kompleks yang berfungsi sebagai katalis dan yang menggabungkan kesederhanaan katalis heterogen dengan keteraturan homogen yang homogen.
Di semikonduktor
Senyawa ini digunakan dalam memperoleh bahan yang dibentuk oleh γ-corpu pada silikon.
Bahan -bahan ini memiliki penggunaan luas pada dioda pemancar cahaya ultraviolet, dioda laser dan detektor cahaya.
Dapat melayani Anda: kalium bromida (KBR): struktur, sifat, penggunaanDi Super Cardpisors
Produk ini diperoleh dalam bentuk nanopartikel kubik atau nanocubes memungkinkan untuk memproduksi supercaders, karena memiliki kecepatan beban yang luar biasa, reversibilitas tinggi dan kehilangan kapasitansi kecil.
SuperCorders adalah perangkat untuk menyimpan energi yang menonjol untuk kepadatan daya tinggi, operasi dalam operasi, siklus pemuatan dan pembuangan yang cepat, stabilitas jangka panjang dan ramah lingkungan.
 Nanocubos CUCL dapat digunakan dalam aplikasi elektronik dan penyimpanan energi. Penulis: Tide He. Sumber: Pixabay.
Nanocubos CUCL dapat digunakan dalam aplikasi elektronik dan penyimpanan energi. Penulis: Tide He. Sumber: Pixabay. Aplikasi lain
Memberi.
 Warna hijau dari beberapa kembang api mungkin karena mendengkur. Penulis: Hans Braxmeier. Sumber: Pixabay.
Warna hijau dari beberapa kembang api mungkin karena mendengkur. Penulis: Hans Braxmeier. Sumber: Pixabay. Referensi
- Milek, J.T. dan neuberger, m. (1972). Cuprous klorida. Dalam: bahan modular elektrooptik linier. Springer, Boston, MA. Tautan pulih.Peloncat.com.
- Timah, d.R. (Editor) (2003). Buku Pegangan Kimia dan Fisika CRC. 85th CRC Press.
- Sneeden, r.P.KE. (1982). Metode penyerapan/disorpsi. Dalam kimia organetalik yang komprehensif. Volume 8. Pulih dari scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Chandrashekhar, v.C. et al. (2018). Kemajuan terbaru dalam sintesis langsung senyawa organetalik dan koordinasi. Dalam sintesis langsung kompleks logam. Pulih dari scientedirect.com.
- Kyushin, s. (2016). Sintesis Organosilikon untuk Konstruksi Cluster Organosilikon. Dalam metode yang efisien untuk persiapan senyawa silikon. Pulih dari scientedirect.com.
- Van Koten, G. dan noltes, j.G. (1982). Senyawa organokopper. Dalam kimia organetalik yang komprehensif. Volume 2. Pulih dari scientedirect.com.
- Danieluk, d. et al. (2009). Sifat optik film CUCL doped oksigen dan oksigen pada silikon sublate. J Mater Sci: Mater Electron (2009) 20: 76-80. Tautan pulih.Peloncat.com.
- Yin, b. et al. (2014). Cuprous klorida nanocubes tumbuh pada tembaga gagal untuk elektroda pseudocapacitor. Nano-Micro Lett. 6, 340-346 (2014). Tautan pulih.Peloncat.com.
- Kim, k. et al. (2018). Ligan amina aromatik yang sangat efisien/tembaga (i) klorida. Polimer 2018, 10, 350. MDPI pulih.com.
- Wikipedia (2020). Tembaga (i) klorida. Diterima dari.Wikipedia.org.
- « Fraksi molar bagaimana itu dihitung, contoh, latihan
- Lemak butirik memperoleh, jenis, komposisi, penggunaan, manfaat »

