Timah klorida (ii)
- 2078
- 399
- Irvin Reichel
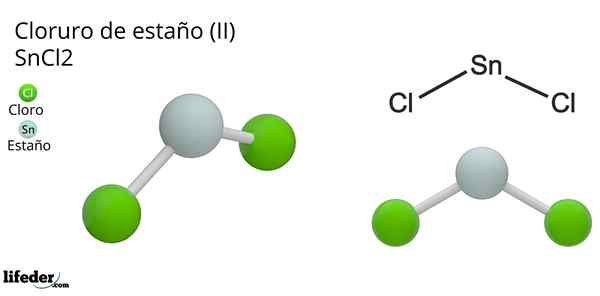
Dia Timah klorida (Ii) atau klorida kecil, dari formula kimia SNCl2, Ini adalah senyawa padat putih dan kristal, produk dari reaksi timah dan larutan asam klorida terkonsentrasi: SN (s) + 2hcl (conc) => snc2(aq) + h2(G). Proses sintesisnya (persiapan) terdiri dari menambahkan potongan timah untuk bereaksi dengan asam.
Setelah menambahkan potongan timah, dehidrasi dan kristalisasi dilakukan sampai garam anorganik diperoleh. Dalam senyawa ini, timah telah kehilangan dua elektron dari lapisan valensi untuk membentuk tautan dengan atom klorin.
Ini dapat dipahami dengan lebih baik jika konfigurasi Valencia Tin dipertimbangkan (5s25 pX2PDan0Pz0), yang pasangan elektron menempati orbital pX ditugaskan ke proton h+, Untuk membentuk molekul hidrogen diatomik. Yaitu, ini adalah reaksi tipe redoks.
[TOC]
Sifat klorida timah
 Timah klorida (II) dihidrat
Timah klorida (II) dihidrat Tautan sncl2 Mereka adalah tipe ionik atau kovalen? Sifat fisik timah klorida (II) membuang opsi pertama. Titik fusi dan didih untuk senyawa ini adalah 247 ºC dan 623 ºC, menunjukkan interaksi antarmolekul yang lemah, fakta umum untuk senyawa kovalen.
Kristal -kristalnya putih, yang diterjemahkan menjadi penyerapan nol dalam spektrum yang terlihat.
Konfigurasi Valencia
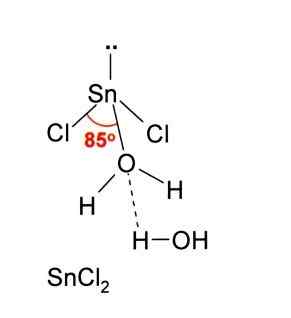
Pada gambar di atas, mint snick terisolasi diilustrasikan2.
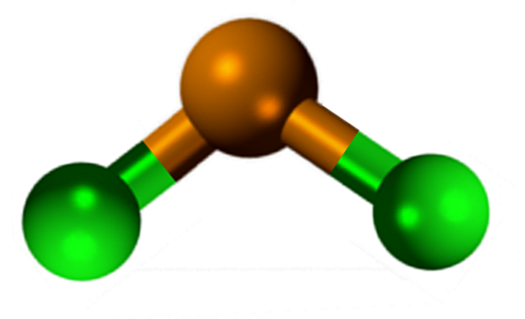
Geometri molekuler harus datar karena hibridisasi atom pusat adalah SP2 (Orbital 3 sp2 dan orbital P murni untuk membentuk ikatan kovalen), tetapi torsi bebas elektron menempati volume dan mendorong atom klorin ke bawah, memberikan molekul geometri sudut.
Dalam fase gas senyawa ini diisolasi, sehingga tidak berinteraksi dengan molekul lain.
Dapat melayani Anda: saponifikasiSebagai kehilangan pasangan elektron di orbital PX, Timah berubah menjadi ion sn2+ dan konfigurasi elektronik yang dihasilkan adalah 5s25 pX0PDan0Pz0, Dengan semua orbitalnya tersedia untuk menerima tautan dari spesies lain.
Ion CL- Mereka berkoordinasi dengan ion sn2+ Untuk menimbulkan klorida timah. Konfigurasi timah elektronik dalam garam ini adalah 5s25 pX2PDan2Pz0, bisa menerima sepasang elektron lain di orbital p gratis Andaz.
Misalnya, Anda dapat menerima Ion CL lain-, membentuk kompleks geometri datar trigonal (piramida dasar segitiga) dan dimuat secara negatif [SNCl3]-.
Reaktivitas
Sncl2 Ini memiliki reaktivitas tinggi dan tren untuk berperilaku sebagai asam Lewis (reseptor elektron) untuk menyelesaikan valencia octet -nya.
Serta menerima ion cl-, Hal yang sama berlaku untuk air, yang "melembabkan" atom timah ketika molekul air dihubungkan langsung dengan timah, dan molekul air kedua membentuk interaksi oleh jembatan hidrogen dengan yang pertama.
Hasilnya adalah bahwa SNCl2 Itu tidak murni, tetapi terkoordinasi dengan air dalam garam dihidrasi: sncl2· 2h2SALAH SATU.
Sncl2 Sangat larut dalam pelarut air dan kutub, karena itu adalah senyawa kutub. Namun, kelarutannya dalam air, kurang dari berat massanya, mengaktifkan reaksi hidrolisis (pecahnya molekul air) untuk menghasilkan garam dasar dan tidak larut:
Sncl2(aq) + h2Atau (l) Sn (OH) Cl (S) + HCl (aq)
Panah ganda menunjukkan bahwa keseimbangan ditetapkan, disukai ke kiri (menuju reagen) jika konsentrasi HCl meningkat. Oleh karena itu, solusi sncl2 Karyawan memiliki pH asam, untuk menghindari presipitasi produk garam yang tidak diinginkan dari hidrolisis.
Ini dapat melayani Anda: Nukleofil: Serangan Nukleofilik, Jenis, Contoh, NukleofilisitasAktivitas reduktif
Bereaksi dengan oksigen udara untuk membentuk timah klorida (IV) atau klorida adalah:
6 sncl2(aq) + o2(g) + 2h2Atau (l) => 2sncl4(aq) + 4SN (OH) Cl (S)
Dalam reaksi ini, timah mengoksidasi membentuk hubungan dengan atom oksigen elektronegatif dan meningkatkan jumlah ikatannya dengan atom klorin.
Secara umum, atom elektronegatif halogen (F, CL, BR dan I) menstabilkan hubungan senyawa SN (IV) dan fakta ini menjelaskan mengapa SNCl2 adalah agen peredam.
Saat teroksidasi dan kehilangan semua elektron valensi, ion Sn4+ adalah konfigurasi 5S05 pX0PDan0Pz0, Menjadi sepasang elektron di orbital 5S yang paling sulit untuk "diambil".
Struktur kimia timah klorida
 Struktur timah klorida (II)
Struktur timah klorida (II) Sncl2 Ini menyajikan struktur kristal tipe ortorombik, mirip dengan baris serruchos, di mana ujung gigi adalah klorida.
Setiap baris adalah rantai SNCl3 membentuk jembatan CL dengan atom SN lain (Cl-Sn (CL)2-Cl- ···). Dua rantai, bersama-sama dengan interaksi lemah dari tipe SN-CL merupakan lapisan pengaturan, yang tumpang tindih di atas lapisan lain, dan seterusnya sampai mendefinisikan padatan kristal.
Pasangan elektron gratis 5s2 Menyebabkan distorsi dalam struktur karena menempati volume (volume awan elektronik).
SN dapat memiliki angka koordinasi yang sama dengan sembilan, yang sama dengan memiliki sembilan tetangga, menarik prisma trigonal dengan ini terletak di tengah sosok geometris dan CL di simpul, di samping CL lain yang terletak di masing -masing wajah -wajah persegi prisma.
Dapat melayani Anda: HidraceIni lebih mudah untuk diamati jika dianggap sebagai rantai di mana Sn (bola abu -abu gelap) menunjuk ke atas, dan tiga CL yang dihubungkan dengan bentuk ini lantai segitiga, sedangkan ketiga klien membentuk atap segitiga atas.
Penggunaan/Aplikasi
Dalam sintesis organik ini digunakan sebagai agen pereduksi senyawa nitro aromatik (AR-no2 à ar-nh2). Karena struktur kimianya adalah laminar, ia menemukan penggunaan di dunia katalisis reaksi organik, selain menjadi kandidat potensial untuk dukungan katalitik.
Properti reduksi dieksploitasi untuk menentukan keberadaan senyawa emas, untuk menutupi kaca dengan cermin perak dan berfungsi sebagai antioksidan.
Juga, dalam piramida trigonal geometri molekulnya (: snx3- M+) digunakan sebagai basis Lewis untuk sintesis sejumlah besar senyawa (seperti kompleks cluster Pt3Sn8Cldua puluh, di mana pasangan bebas elektron dikoordinasikan dengan asam lewis).
Risiko
Sncl2 Anda dapat merusak sel darah putih. Ini korosif, menjengkelkan, karsinogenik, dan memiliki dampak negatif yang tinggi pada spesies yang menghuni ekosistem laut.
Dapat membusuk pada suhu tinggi, melepaskan gas klor yang berbahaya. Kontak dengan agen pengoksidasi yang sangat memicu reaksi eksplosif.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. Di dalam Elemen Grup 14 (edisi keempat., P. 329). MC Graw Hill.
- Buku Kimia. (2017). Chemicalbook: Chemicalbook.com
- Pubchem. (2018). Timah klorida. Pubchem pulih: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2017). Timah (ii) klorida. Wikipedia pulih: di.Wikipedia.org
- F. Hulliger. (1976). Kimia struktural fase tipe lapisan. P-120.121. D. Perusahaan Penerbitan Reidel.

