Struktur besi klorida (III), sifat, memperoleh, menggunakan
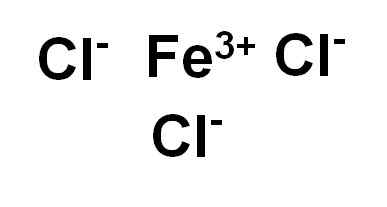
- 4809
- 672
- Domingo Gutkowski
Dia Besi klorida (III) Ini adalah senyawa anorganik yang dibentuk oleh besi (iman) dan elemen klorin (CL). Formula kimianya adalah FECL3. Itu adalah padatan kristal yang warnanya bisa dari oranye ke coklat kehitaman.
FECL3 Mudah dilarutkan dalam air membentuk larutan berair asam di mana dengan meningkatkan pH membuatnya lebih basa.
 Besi klorida (III) atau ferric chloride fecl3 padat. Еор осин/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons.
Besi klorida (III) atau ferric chloride fecl3 padat. Еор осин/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons. Besi klorida (III) digunakan untuk mengencangkan partikel -partikel yang mencemari air limbah kota atau industri. Dikatakan bahwa itu memungkinkan Anda untuk menghilangkan beberapa parasit dan berfungsi untuk menghentikan kehilangan darah dari hewan pada hewan dan untuk penyembuhan ini.
Itu berfungsi untuk mengekstrak tembaga (ii) dari mineral tembaga sulfida. Ini juga digunakan dalam berbagai reaksi kimia dan analisis laboratorium biologis dan kimia. Misalnya, ia berfungsi untuk mendeteksi senyawa sebagai fenol dalam minyak yang diekstraksi dari tanaman. Ini digunakan dalam sirkuit elektronik, di penyamak kulit dan dalam fotografi.
Karena menjadi FECL3 Senyawa asam bersifat korosif untuk kulit dan selaput lendir. Debu senyawa ini harus dihindari. Itu tidak boleh dibuang ke lingkungan.
[TOC]
Struktur
Besi klorida (III) atau ferric chloride fecl3 Itu adalah senyawa ionik dan dibentuk oleh iman besi3+ dan tiga ion klorida CL-. Besi berada dalam keadaan oksidasi +3 dan setiap klorin memiliki Valencia -1.
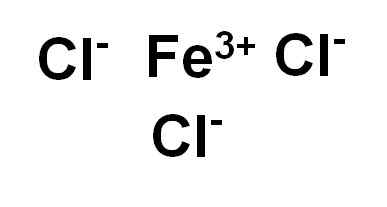 Besi klorida (III) atau ferric chloride. Penulis: Marilú Stea.
Besi klorida (III) atau ferric chloride. Penulis: Marilú Stea. Tata nama
- Besi klorida (III)
- Besi klorida
- Besi triklorida
- Muriature besi
Properti
Keadaan fisik
Oranye solid kristal hingga coklat kehitaman.
 Ferric chloride fecl3 anhidrat (tanpa air). Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Ferric chloride fecl3 anhidrat (tanpa air). Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Berat molekul
Anhidro FECL3 = 162.2 g/mol
Titik lebur
Anhidro FECL3 = 304 ºC
Hexahidrat FECL3 •6h2O = 37 ° C
Titik didih
Anhidro FECL3 = Sekitar 316 ºC
Hexahidrat FECL3 •6h2O = 280-285 ° C
Kepadatan
Anhidro FECL3 = 2,90 g/cm3 pada 25 ° C
Kelarutan
Sangat larut dalam air: 74,4 g/100 g air pada 0 ° C; 535,7 g/100 g air pada 100 ° C. Sangat larut dalam aseton, etanol, eter dan metanol. Lemak larut dalam pelarut non -polar seperti benzena dan heksana.
Dapat melayani Anda: Boron: Sejarah, Properti, Struktur, Penggunaanph
Solusi berairnya sangat asam. Solusi 0,1 mol FECL3 per liter air memiliki pH 2.0.
Sifat kimia
Saat fadl larut dalam air3 Itu dihidrolisis; yaitu, ia terpisah dalam ion imannya3+ dan 3 cl-. Keyakinan3+ membentuk ion hexaacuohierro [iman (h2SALAH SATU)6]3+ Tapi ini dikombinasikan dengan ion OH- dari air yang membentuk spesies campuran dan melepaskan proton h+.
Karena alasan ini solusi mereka bersifat asam. Jika pH meningkat, spesies ini membentuk gel dan akhirnya endapan atau padatan dari iman oksida besi terhidrasi terbentuk2SALAH SATU3 •NH2SALAH SATU.
Kristal besi klorida (III) adalah higroskopis, yaitu, mereka menyerap air dari lingkungan. Saat basah itu korosif untuk aluminium dan banyak logam.
 Solusi FECL3 Mereka bisa sangat asam dan korosif, karena mengandung HCl. Kanesskong/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Solusi FECL3 Mereka bisa sangat asam dan korosif, karena mengandung HCl. Kanesskong/CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Solusi berair FECL3 Mereka sangat asam dan korosif untuk sebagian besar logam. Mereka memiliki aroma asam hidroklorat HCl yang lemah. Saat FECL dipanaskan sampai dekomposisinya3 memancarkan gas HCl yang sangat beracun.
Memperoleh
Besi klorida (III) diproduksi oleh klorinasi langsung zat besi dengan bereaksi klorin kering (CL2) Dengan bekas besi (iman) pada 500-700 ° C.
Reaksi dilakukan dalam reaktor yang tahan asam. Langkah pertama adalah meleleh pada 600 ° C campuran besi klorida (III) (FECL3) dan kalium klorida (KCL).
 FECL3 Itu harus disiapkan dalam wadah yang sangat tahan terhadap asam seperti stainless steel. Penulis: Johannes Plenio. Sumber: Pixabay.
FECL3 Itu harus disiapkan dalam wadah yang sangat tahan terhadap asam seperti stainless steel. Penulis: Johannes Plenio. Sumber: Pixabay. Kemudian bekas besi (iman) dilarutkan dalam campuran cair di mana besi bereaksi dengan FECL3 Dan itu menjadi ferrous chloride (FECL2).
Fe + 2 FECL3 → 3 FECL2
Lalu FECL2 bereaksi dengan klorin CL2 membentuk FECL3 yang bersublimat (beralih dari keadaan padat ke gas secara langsung) dan dikumpulkan di ruang kondensasi khusus.
2 FECL2 + Cl2 → 2 FECL3
Anda juga dapat bereaksi feso feso sulfat ferrous4 dengan klorin CL2.
Hexahidrat FECL3 •6h2O Dapat diperoleh dengan menguapkan solusi berair ion iman3+ dan Cl- Di kamar mandi uap.
Dapat melayani Anda: senyawa kuaterner: karakteristik, pelatihan, contohKehadiran di alam
Ferric chloride atau besi klorida (III) ditemukan dalam bentuk dalam bentuk mineral mo -mineral, yang ditemukan di lava fumaroles gunung berapi aktif. Di antara gunung berapi tempat Anda dapat menemukannya adalah Mount Vesubio.
 FECL3 Itu adalah bagian dari bijih moysite yang ada di gunung berapi aktif. Penulis: Skeze. Sumber: Pixabay.
FECL3 Itu adalah bagian dari bijih moysite yang ada di gunung berapi aktif. Penulis: Skeze. Sumber: Pixabay. Aplikasi
Dalam pengolahan air limbah
Ferric chloride digunakan untuk mengolah air limbah kota atau industri melalui sedimentasi kimia.
Ini bertindak sebagai koagulan yang mendukung penyatuan beberapa partikel satu sama lain, dengan cara ini konglomerat atau partikel yang lebih besar terbentuk yang cenderung flokuler atau sedimen (menurunkan berat badan mereka sendiri ke bagian bawah air yang sedang diolah).
 FECL3 Ini digunakan untuk memisahkan bahan yang tidak diinginkan dari perairan yang dibuang oleh masyarakat atau industri. Penulis: 后园 卓. Sumber: Pixabay.
FECL3 Ini digunakan untuk memisahkan bahan yang tidak diinginkan dari perairan yang dibuang oleh masyarakat atau industri. Penulis: 后园 卓. Sumber: Pixabay. Dengan cara ini pemisahan padatan air disukai dan ini bebas dari bahan yang tidak diinginkan.
Jenis perawatan ini dapat memfasilitasi pengangkatan parasit, seperti protozoa, yang merupakan mikroorganisme yang dibentuk oleh sel tunggal, seperti amibas, yang menyebabkan penyakit.
Untuk alasan ini FECL3 Itu juga digunakan untuk memurnikan air.
Dalam prosedur penyembuhan veteriner
Besi klorida (III) digunakan untuk menyembuhkan cedera hewan.
Ini berfungsi sebagai astringen lokal (Anda dapat menarik kembali jaringan dan bertindak sebagai anti -inflamasi dan penyembuhan) dan hemostatik (menghentikan pendarahan atau kehilangan darah).
Itu digunakan dalam bubuk untuk menghentikan kehilangan darah atau ketika kuda telah dipotong menjadi ternak. Ini juga digunakan dalam larutan untuk menghentikan pendarahan ketika cakar dipotong atau kutil dihilangkan.
 FECL3 Ini digunakan dalam bubuk yang diterapkan pada sapi memotong tanduk dan menghindari infeksi. Penulis: Jaclou DL. Sumber: Pixabay.
FECL3 Ini digunakan dalam bubuk yang diterapkan pada sapi memotong tanduk dan menghindari infeksi. Penulis: Jaclou DL. Sumber: Pixabay. Ini juga digunakan untuk mengobati faringitis (peradangan faring) atau stomatitis (peradangan mukosa oral) dan untuk meningkatkan hemoglobin darah pada beberapa burung.
Dalam ekstraksi logam
Besi klorida (III) atau ferric chloride fecl3 Ini digunakan untuk mengekstrak tembaga (ii) bijih tembaga yang mengandung sulfida logam tersebut.
Dapat melayani Anda: hidroksidaIni adalah metode oksidatif yang memadai untuk menghindari pelepasan gas sulfur dioksida beracun (jadi2), karena alih -alih ini dihasilkan belerang. Solusi dengan konsentrasi FECL tinggi diproduksi2, FECL3, CUCL2 dan klorida logam lainnya.
4 FECL3 + Cu2S ⇔ 4 FECL2 + 2 CUCL2 + S ↓
Sebagai reagen laboratorium kimia dan biologis
Di antara banyak penggunaan kimia berfungsi untuk menunjukkan keberadaan kelompok fenolik (yaitu, kelompok -OH yang melekat pada cincin benzena).
Senyawa ini dilarutkan untuk dianalisis dalam etanol dan beberapa tetes larutan FECL ditambahkan3. Ketika senyawa memiliki kelompok -oh yang melekat pada cincin benzena (yaitu, itu adalah fenol), warna hijau kebiruan terbentuk.
Tes ini memungkinkan untuk menganalisis keberadaan fenol dalam ekstrak tanaman.
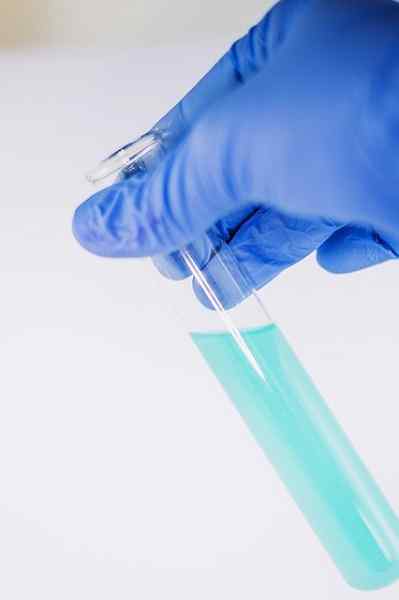 FECL3 Di hadapan fenol itu memberikan warna hijau kebiruan. Penulis: Ewa Urban. Sumber: Pixabay.
FECL3 Di hadapan fenol itu memberikan warna hijau kebiruan. Penulis: Ewa Urban. Sumber: Pixabay. Ini juga digunakan dalam tes untuk menentukan aktivitas antioksidan minyak tertentu yang diekstraksi dari sayuran.
Aplikasi lainnya adalah memungkinkan untuk menyiapkan senyawa kimia lainnya. Ini juga dapat bertindak sebagai zat pengoksidasi, klorinasi (menyediakan klorin) dan kondensor (untuk bergabung dengan dua atau lebih molekul satu sama lain).
Ini juga berfungsi sebagai katalis atau akselerator reaksi kimia organik.
Dalam beberapa aplikasi
Ferric chloride digunakan dalam sirkuit elektronik tercetak. Dengan warna berbagai bentuk terhidrasi, ia berfungsi sebagai pigmen dan digunakan dalam penyamak kulit.
 FECL3 Itu digunakan dalam penyamakan kulit. Penulis: Pexels. Sumber: Pixabay.
FECL3 Itu digunakan dalam penyamakan kulit. Penulis: Pexels. Sumber: Pixabay. Itu adalah desinfektan. Ini digunakan untuk mengobati gangguan kulit dan juga digunakan dalam fotografi.
Risiko
Bubuk feCl3 Itu menjengkelkan mata, hidung dan mulut. Jika menghirup dapat menyebabkan batuk atau kesulitan bernapas. Ini adalah senyawa korosif, jadi kontak yang berkepanjangan dengan kulit dan dengan mata atau selaput lendir dapat menyebabkan kemerahan dan luka bakar.
Itu tidak mudah terbakar, tetapi ketika dipanaskan pada suhu tinggi menghasilkan gas hidrogen klorida HCl, yang beracun dan sangat korosif.
FECL3 Ini berbahaya bagi organisme akuatik dan tanah. Jika secara tidak sengaja dibuang ke lingkungan, keasamannya dengan senyawa dasar harus dinetralkan.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Besi klorida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 19. Edisi keempat. John Wiley & Sons.
- Ensiklopedia Kimia Industri Ullmann. (1990). Edisi Kelima. Volume A22. Vch verlagsgellschaft mbh.
- Ngameni, b. et al. (2013). Flavonoid dan senyawa terkait dari tanaman obat Afrika. Karakterisasi flavonoid dalam ekstrak tanaman. Tes ferrik klorida. Dalam penelitian tanaman obat di Afrika. Pulih dari scientedirect.com.
- Agyare, c. et al. (2017). Petroselinum Crispum: Sebuah Ulasan. Aktivitas antioksidan. Di Spartes dan Sayuran Obat dari Afrika. Pulih dari scientedirect.com.
- Stott, r. (2003). Nasib dan perilaku parasit dalam sistem pengolahan air limbah. Sedimentasi yang dibantu secara kimia. Dalam Buku Pegangan Mikrobiologi Air dan Air Limbah. Pulih dari scientedirect.com.
- Tasker, hlm.KE. et al. (2003). Aplikasi Kimia Koordinasi. Ekstraksi CuIi Dari solusi klorida. Dalam memahami kimia koordinasi. Pulih dari scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.

