Sifat mangan klorida, struktur, penggunaan, risiko

- 1729
- 259
- Mr. Darrell Streich
Dia Klorida Mangan Itu adalah garam anorganik yang formula kimianya mcl2. Itu terdiri dari ion MN2+ dan Cl- dalam rasio 1: 2; untuk setiap kation mn2+ Ada dua kali dari anion CL-.
Garam ini dapat membentuk beberapa hidrat: mncl2· 2h2Atau, (dihidrat), mcl2· 4h2Atau (tetrahydrate), dan mcl2· 6h2Atau (heksahidrat) Bentuk garam yang paling umum adalah tetrahidrat.
 Kristal Mangan Pink Mangan. Sumber: Ondřej Mangl [domain publik]
Kristal Mangan Pink Mangan. Sumber: Ondřej Mangl [domain publik] Sifat fisik mangan klorida seperti kepadatan, peleburan dan titik kelarutan dalam air, dipengaruhi oleh tingkat hidrasi mereka. Misalnya, titik leleh bentuk anhidra jauh lebih besar dari bentuk tetrahidrat.
Warna mangan klorida pucat merah muda (gambar superior). Lendor adalah karakteristik dari garam logam transisi. Mangan klorida adalah asam Lewis yang lemah.
Mineral yang dikenal sebagai Escacquita adalah bentuk anhidrat alami mangan klorida (II); Seperti Kempita.
Mangan klorida (II) digunakan sebagai agen paduan; Katalis dalam reaksi klorinasi, dll.
[TOC]
Properti fisik
Penampilan fisik
- Bentuk Anhydra: Kristal Kubik Merah Muda.
- Bentuk tetrahidrat: kristal monoklinik kemerahan yang sedikit halus.
Massa molar
- Anhidro: 125.838 g/mol.
- Dihydrared: 161.874 g/mol.
- Tetrahydrate: 197.91 g/mol.
Poin fusi
- Anhidro: 654 ºC.
- Dihydrared: 135 ºC.
- Tetrahydrate: 58 ºC.
Titik didih
Formulir Anhidra: 1.190 ºC.
Kepadatan
- Anhydrous: 2.977 g/cm3.
- Dihydrared: 2.27 g/cm3.
- Tetrahydrate: 2.01 g/cm3.
Kelarutan air
Bentuk Anhydra: 63.4 g/100 ml pada 0 ºC; 73.9 g/100 ml pada 20 ºC; 88,5 g/100 ml pada 40 ° C; dan 123,8 g/100 ml pada 100 ° C.
Kelarutan dalam pelarut organik
Larut dalam piridin dan etanol, tidak larut dalam eter.
Penguraian
Kecuali jika tindakan pencegahan diambil, dehidrasi bentuk terhidrasi ke bentuk anhidrat dapat menyebabkan dehidrasi hidrolitik, dengan produksi hidrogen klorida dan mangan oxychlorideese.
ph
Solusi 0,2 m dari tetrahidrat mangan klorida dalam larutan berair memiliki pH 5,5.
Dapat melayani Anda: kromatogramStabilitas
Ini stabil, tetapi sensitif terhadap kelembaban dan tidak sesuai dengan asam yang kuat, logam reaktif dan hidrogen peroksida.
Struktur mangan klorida
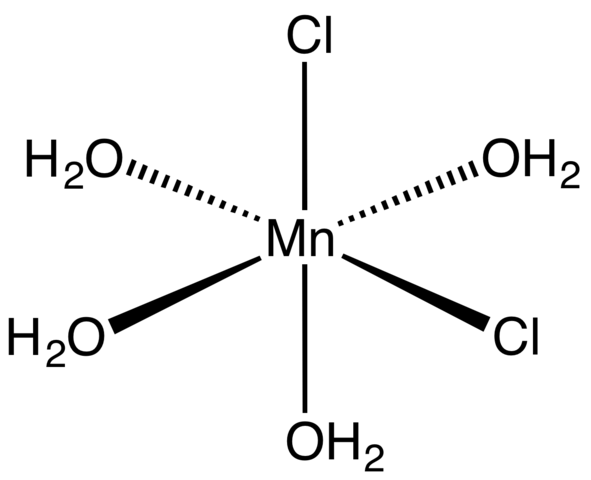 Kompleks Koordinasi untuk MNCL2 Tetrahydrate. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Kompleks Koordinasi untuk MNCL2 Tetrahydrate. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Dimulai dengan garam tetrahidrat, kristal merah muda dan mencolok, harus terdiri dari kompleks koordinasi (gambar superior). Di dalamnya, pusat logam MN2+ dikelilingi oleh oktahedron yang ditentukan oleh empat molekul H2Atau dan dua anion CL-.
Perhatikan bahwa ligan CL- Mereka berada di posisi CIS; Semua setara di dasar persegi panjang octaedro, dan tidak masalah jika CL "dipindahkan"- ke salah satu dari tiga posisi lainnya. Isomer lain yang mungkin untuk molekul terkoordinasi ini adalah di mana keduanya CL- Mereka berada di posisi trans; yaitu, di ujung yang berbeda (satu di atas dan yang lainnya di bawah).
Keempat molekul air dengan jembatan hidrogen mereka memungkinkan dua atau lebih octahedra untuk bergabung dengan pasukan dipol-dipolo. Jembatan ini sangat terarah, dan menambahkan interaksi elektrostatik antara MN2+ dan Cl-, Mereka membangun karakteristik struktur yang tertib dari kristal.
Warna merah muda MNCl2· 4h2Atau karena transisi elektronik MN2+ dan konfigurasinya5. Demikian juga, gangguan yang disebabkan oleh sekitar molekul air dan klorida memodifikasi jumlah energi yang diperlukan yang harus diserap oleh elektron tersebut5 Untuk melakukan perjalanan tingkat energi yang lebih tinggi.
Dihidrat
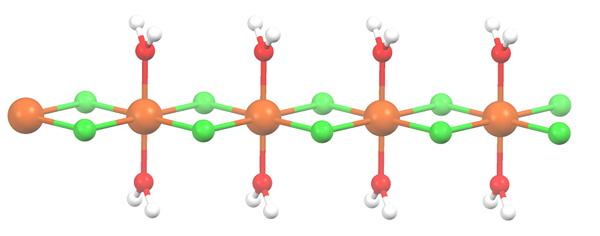 Struktur polimer untuk mncl2 · 2h2o. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Struktur polimer untuk mncl2 · 2h2o. Sumber: Smokefoot [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Garam mengalami dehidrasi dan formulanya sekarang menjadi mcl2· 2h2SALAH SATU. Apa yang terjadi pada octahedron anterior? Tidak ada, kecuali bahwa kedua molekul H2Atau bahwa mereka ditinggalkan digantikan oleh dua CL-.
Pada awalnya Anda dapat memberikan kesan yang salah bahwa ada empat CL- untuk setiap MN2+; Namun, setengah dari octahedron (aksial) sebenarnya adalah unit gelas yang berulang.
Jadi, memang benar bahwa ada MN2+ terkoordinasi di dua CL- dan dua molekul air di posisi trans. Tetapi agar unit ini berinteraksi dengan yang lain, ia membutuhkan dua jembatan CL, yang pada gilirannya memungkinkan koordinasi octahedron agar mangan selesai.
Dapat melayani Anda: elemen diatomikSelain jembatan CL, molekul air juga berkolaborasi dengan jembatan hidrogen mereka sehingga rantai MNCl ini2· 2h2Atau jangan melucuti senjata.
Anhidrat
Akhirnya, magnesium klorida telah selesai kehilangan semua air yang terkandung dalam kristal; Anda memiliki garam anhydra sekarang, mcl2. Tanpa molekul air, kristal secara signifikan kehilangan intensitas warna merah muda mereka. Octahedron, seperti untuk hidrat, tetap tidak berubah oleh sifat mangan itu sendiri.
Tanpa molekul air, MN2+ ujung dikelilingi oleh seorang octahedron yang hanya terdiri dari cl-. Tautan koordinasi ini memiliki karakter kovalen dan ionik; Untuk alasan ini biasanya merujuk pada struktur MNCl2 seperti kristal polimer. Di dalamnya ada lapisan alternatif MN dan CL.
Tata nama
Orang mangan memiliki banyak keadaan oksidasi yang mungkin terjadi. Karena itu, nomenklatur tradisional untuk MNCl2 Itu tidak diklarifikasi.
Di sisi lain, mangan klorida sesuai dengan nama yang paling terkenal, yang kurang akan menambahkan '(ii)' sehingga menurut stok nomenklatur: mangan klorida (ii). Dan Asçi, adalah nomenklatur sistematis: Dichloride mangan.
Aplikasi
Laboratorium
Mangan klorida berfungsi sebagai katalis untuk klorinasi senyawa organik.
Industri
Mangan klorida digunakan sebagai bahan baku untuk elaborasi anti -partisantes untuk bensin; bahan pengelasan untuk logam non -jantan; perantara dalam elaborasi pigmen; Dan minuman minyak linaza.
Ini digunakan dalam industri tekstil untuk dicetak dan diwarnai; Dalam produksi beberapa garam mangan, termasuk tricarbonil dari methylciclopentadienilmangan yang digunakan sebagai pewarna bata; dan dalam produksi baterai listrik kering.
Mangan klorida digunakan sebagai agen paduan dan ditambahkan ke magnesium cair untuk menghasilkan paduan mangan-magnesium; sebagai perantara dalam persiapan agen pengeringan untuk melukis dan pernis; dan sebagai komponen desinfektan.
Dapat melayani Anda: natrium hidroksida (NaOH): struktur, sifat, penggunaan, sintesisIni juga digunakan dalam pemurnian magnesium.
Pupuk dan pakan ternak
Manganese chloride is used as a source of manganese, element, which, although not a primary nutritional element for plants such as nitrogen, phosphorus and potassium, is used in numerous biochemical reactions of these living beings of these living beings.
Ini juga menambah pakan hewan pengembangbiakan untuk pasokan mangan, oligoensi penting untuk pertumbuhan hewan.
Mangan klorida adalah komponen makanan yang memasok mangan, unsur yang mengintervensi dalam berbagai proses yang diperlukan untuk kehidupan, termasuk: sintesis asam lemak dan hormon seks; Asimilasi Vitamin E; produksi tulang rawan; dll.
Risiko
Ini dapat menghasilkan melalui kontak dengan kemerahan kulit, iritasi dan dermatitis paparan yang berkepanjangan. Mangan klorida menyebabkan kemerahan, rasa sakit dan air mata.
Dengan menghirup penyebab garam, sakit tenggorokan dan kurang napas. Di sisi lain, konsumsi dapat terjadi muntah, mual dan diare.
Penghirupan kronis yang berlebihan dari garam ini dapat menyebabkan peradangan paru dan penyakit reaktif berikutnya dari saluran udara.
Konsumsi yang berlebihan dapat menyebabkan gangguan mental, dehidrasi, hipotensi, kegagalan hati dan ginjal, kegagalan sistem multiorgan dan kematian dan kematian.
Neurotoksisitas adalah manifestasi awal dari aksi mangan yang tidak diinginkan, mampu menyajikan sakit kepala, pusing, kehilangan ingatan, hiperrefleksia, dan tremor ringan.
Toksisitas parah dimanifestasikan oleh gejala dan tanda -tanda yang serupa dengan yang diamati pada penyakit Parkinson.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Mangan (ii) klorida. Diperoleh dari: di.Wikipedia.org
- Nanomaterial Sky Spring. (2016). Bubuk mangan klorida. Pulih dari: ssnano.com
- Buku Kimia. (2017). Mangan klorida. Dipulihkan dari: Chemicalbook.com
- Jaringan Data Toksikologi. (S.F.). Mangan klorida. Toxnet. Pulih dari: Toxnet.Nlm.Nih.Pemerintah
- Gérard Cahiez. (2001). Mangan (ii) klorida. doi.org/10.1002/047084289x.RM020
- Pusat Nasional Informasi Bioteknologi. (2019). Dichloride Mangan. Database pubchem. CID = 24480. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- WebConsultas Healthcare, s.KE. (2019). Mineral: Mangan. Dipulihkan dari: Web Consultas.com

