Sifat timah klorida, struktur, penggunaan

- 3690
- 1009
- Frederick Pfeffer
Dia Timbal klorida Ini adalah garam anorganik yang formula kimianya adalah PBCLN, Di mana n adalah jumlah oksidasi timbal. Jadi, ketika timbal seperti +2 atau +4, garam adalah pbcl2 atau pbcl4, masing -masing. Oleh karena itu, ada dua jenis klorida untuk logam ini.
Dari keduanya, PBCL2 Ini adalah yang paling penting dan stabil; sedangkan PBCL4 tidak stabil dan kurang berguna. Yang pertama adalah sifat ionik, di mana kation PB2+ menghasilkan interaksi elektrostatik dengan cl anion- untuk membangun jaringan kristal; Dan yang kedua, adalah kovalen, dengan tautan PB-CL yang berasal dari timah dan klorin tetrahedron.
 Jarum PBCL2 yang diendapkan. Sumber: rrausch1974 [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Jarum PBCL2 yang diendapkan. Sumber: rrausch1974 [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Perbedaan lain antara timah klorida adalah bahwa PBCL2 Ini adalah padatan kristal berbentuk kaca putih (gambar superior); sedangkan PBCL4 Ini adalah minyak kekuningan yang dapat mengkristal pada -15ºC. Input PBCL2 Ini lebih estetika daripada PBCL4.
Selain yang disebutkan di atas, PBCL2 Itu ditemukan di alam sebagai mineral cotunite; sedangkan PBCL4 Tidak, karena rentan terhadap dekomposisi. Saat dari PBCL4 Anda bisa mendapatkan PBO2, dari PBCL2 Mereka memperoleh variasi senyawa organomethalic yang tak ada habisnya.
[TOC]
Properti
Sifat -sifat timbal klorida tergantung pada esensi dari jumlah oksidasi timbal; Karena, klorin tidak berubah, tetapi cara berinteraksi dengan timbal. Oleh karena itu, kedua senyawa harus ditangani; Timbal klorida (ii) di satu sisi, dan timbal klorida (iv) di sisi lain.
-Timbal klorida (II)
Masa molar
278.10 g/mol.
Penampilan fisik
Kristal berwarna putih dengan bentuk jarum.
Kepadatan
5.85 g/ml.
Titik lebur
501ºC.
Titik didih
950ºC.
Kelarutan air
10.8 g/l pada 20ºC. Itu sedikit larut dan air harus dipanaskan sehingga sejumlah besar dapat dibubarkan.
Itu dapat melayani Anda: nikel hidroksida (ii): struktur, sifat, penggunaan, risikoIndeks bias
2.199.
Timbal klorida (iv)
Masa molar
349.012 g/mol.
Penampilan fisik
Cairan berminyak kekuningan.
Kepadatan
3.2 g/ml.
Titik lebur
-15ºC.
Titik didih
50ºC. Pada suhu yang lebih tinggi, ia memecah pelepasan gas klorin:
Pbcl4(s) => pbcl2(S) + Cl2(G)
Faktanya, reaksi ini bisa sangat eksplosif, jadi PBCL disimpan4 Dalam asam sulfat pada -80ºC.
Struktur
-Timbal klorida (II)
Awalnya, sebutkan dibuat bahwa PBCL2 Itu adalah senyawa ionik, jadi terdiri dari ion PB2+ dan Cl- yang membangun kristal di mana rasio PB ditetapkan: CL sama dengan 1: 2; Yaitu, ada dua serta anion CL- Kation apa PB2+.
Hasilnya adalah bahwa kristal orthorrombic terbentuk yang ionnya dapat diwakili dengan model bola dan batang seperti pada gambar yang lebih rendah.
 Struktur cotunite. Sumber: Benjah-BMM27 [Domain Publik].
Struktur cotunite. Sumber: Benjah-BMM27 [Domain Publik]. Struktur ini juga sesuai dengan mineral cotunite. Meskipun batang digunakan untuk menunjukkan arah tautan ionik, itu tidak boleh disamakan dengan tautan kovalen (atau setidaknya murni kovalen)).
Dalam kristal Ortorombik tersebut, PB2+ (Grillian Spheres) memiliki sembilan CL- (bola hijau) Di sekitarnya, seolah -olah dia terkunci di dalam prisma segitiga. Untuk struktur yang rumit, dan kepadatan ionik rendah dari PB2+, Molekulnya sulit dipecahkan kaca; Alasan mengapa itu sedikit larut dalam air dingin.
Molekul fase gas
Ketika kristal maupun cairan tidak dapat menahan suhu tinggi, ion mulai menguap sebagai molekul PBCL2 bijaksana; yaitu, dengan ikatan kovalen CL-PB-CL dan sudut 98º, seolah-olah itu adalah bumerang. Kemudian dikatakan bahwa fase gas terdiri dari molekul PBCL ini2 dan bukan ion yang dibawa oleh arus udara.
Dapat melayani Anda: elektronegativitasTimbal klorida (iv)
Sementara itu, PBCL4 Itu adalah senyawa kovalen. Karena? Karena kation PB4+ Itu lebih kecil dan juga memiliki kepadatan beban ion yang lebih besar dari PB2+, yang menyebabkan polarisasi yang lebih besar dari awan elektronik CL-. Hasilnya adalah alih -alih interaksi dari tipe ionik Pb4+Cl-, Tautan kovalen PB-CL terbentuk.
Mempertimbangkan ini, kesamaan antara PBCL dipahami4 Dan, misalnya, CCL4; Keduanya disajikan sebagai molekul individu tetrahedral. Dengan demikian, dijelaskan mengapa timbal klorida ini adalah minyak kekuningan dalam kondisi normal; Atom -atom CL adalah beberapa yang terkait satu sama lain dan "tergelincir" ketika dua molekul PBCL4 Mereka datang.
Namun, ketika suhu turun dan molekul menjadi lebih lambat, probabilitas dan efek dipol instan meningkat (PBCL4 Itu adalah apolar yang diberikan simetri); Dan kemudian, minyak membeku sebagai kristal heksagonal kuning:
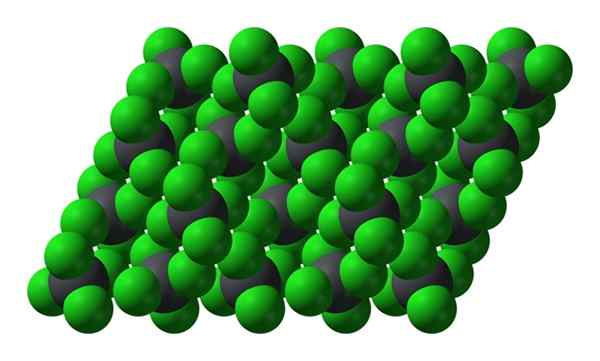 Struktur kristal PBCL4. Sumber: Benjah-BMM27 [Domain Publik]
Struktur kristal PBCL4. Sumber: Benjah-BMM27 [Domain Publik] Perhatikan bahwa setiap bola keabu -abuan dikelilingi oleh empat bola hijau. Molekul PBCL ini4 "Dibebankan" membuat kristal yang tidak stabil dan rentan untuk membusuk dengan kuat.
Tata nama
Nama -nama: timbal klorida (II) dan timbal klorida (iv) sesuai dengan yang ditugaskan sesuai dengan nomenklatur stok. Karena angka oksidasi +2 adalah yang terkecil untuk timbal, dan +4 terbesar, kedua klorida dapat dinamai sesuai dengan nomenklatur tradisional sebagai plumbose klorida (PBCL2), dan plúbic chloride (PBCL4), masing -masing.
Dan akhirnya adalah nomenklatur sistematis, yang menyoroti jumlah masing -masing atom senyawa. Dengan demikian, PBCL2 Itu adalah timah dichloride, dan pbcl4 timbal tetrachloride.
Itu dapat melayani Anda: ketidakpercayaan bahan kimiaAplikasi
Penggunaan praktis untuk PBCL tidak diketahui4 Selain menyajikan sintesis PBO2. Namun, PBCL2 Ini lebih berguna dan itulah sebabnya hanya beberapa kegunaan untuk timah klorida spesifik ini yang akan tercantum di bawah ini:
- Karena sifatnya yang sangat bercahaya, ia ditakdirkan untuk detektor fotografi, akustik, optik dan radiasi.
- Tidak menyerap di daerah spektrum inframerah, digunakan untuk pembuatan kaca yang mentransmisikan jenis radiasi ini.
- Dia telah menjadi bagian dari apa yang mereka sebut kaca aureno, bahan yang menarik dari warna kebiruan berwarna -warni yang digunakan untuk keperluan hias.
- Juga, mengikuti tema seni, saat Anda dihubungi, PBCL2· PB (OH)2 memperoleh nuansa keputihan yang intens, menggunakan pigmen timbal putih. Namun, penggunaannya telah berkecil hati karena toksisitasnya yang tinggi.
- Meleleh dan dicampur dengan barium titanate, batio3, berasal dari keramik titanato barium dan lead ba1 - xPbXPaman3. Jika pb2+ Masukkan Batio3, A ba2+ Anda harus meninggalkan kaca untuk memungkinkan penggabungannya, dan kemudian dikatakan bahwa pertukaran kation terjadi; Itulah sebabnya komposisi BA2+ Itu dinyatakan sebagai 1-x.
- Dan akhirnya, dari PBCL2 Beberapa senyawa organometalic dari rumula formula umum disintesis r4Pb atau r3PB-PBR3.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Timbal (ii) klorida. Diperoleh dari: di.Wikipedia.org
- Formulasi Kimia. (2019). Timbal klorida (iv). Pulih dari: formulasi quimica.com
- Clark Jim. (2015). Klorida karbon, silikon, dan timah. Pulih dari: chemguide.bersama.Inggris
- Studi spektral dan nonlinier optik pada timbal klorida (PBCL2) Kristal. [PDF]. Pulih dari: shodhganga.Infibnet.Ac.di dalam
- Pusat Nasional Informasi Bioteknologi. (2019). Timbal klorida. Database pubchem; CID = 24459. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah

