Merkurius klorida (II) Struktur, sifat, memperoleh, menggunakan

- 657
- 165
- Ernesto Mueller
Dia Merkurius klorida (II) Ini adalah senyawa anorganik yang dibentuk oleh atom merkuri logam (Hg) dan dua atom dari klorenin halogen (CL). Merkuri berada dalam keadaan oksidasi +2 dan klorin -1.
Formula kimianya adalah HGCL2. Ini adalah padatan kristal yang sedikit mudah menguap pada suhu kamar. Serikat pekerja di antara atom -atom mereka lebih kovalen daripada ionik.
 Merkurius klorida (II). Mrgreen71/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons.
Merkurius klorida (II). Mrgreen71/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/3.0). Sumber: Wikimedia Commons. Saat larut dalam air, ia mempertahankan struktur molekulnya. Itu juga larut dalam beberapa pelarut organik. Oleh cahaya cahaya cenderung membentuk merkuri logam.
Di masa lalu itu digunakan sebagai antiseptik dan untuk mengobati penyakit menular tertentu, baik pada manusia maupun hewan. Juga sebagai insektisida untuk mengendalikan hama seperti semut dan rayap.
Namun, ketika toksisitas tinggi mereka diverifikasi, sebagian besar penggunaan ini ditinggalkan dan saat ini hanya digunakan dalam kimia atau laboratorium analisis biokimia.
Dapat dieksploitasi dalam kondisi tertentu. Ini adalah senyawa beracun, itu menyebabkan kerusakan pada manusia, hewan dan tumbuhan. Itu tidak boleh dibuang ke lingkungan. Itu juga diduga karsinogen.
[TOC]
Struktur
Merkurius klorida terdiri dari Hg dalam oksidasi II dan klorin dengan valencia -1. Dalam haluro ini, hubungan antara atom memiliki karakter kovalen yang sangat jelas.
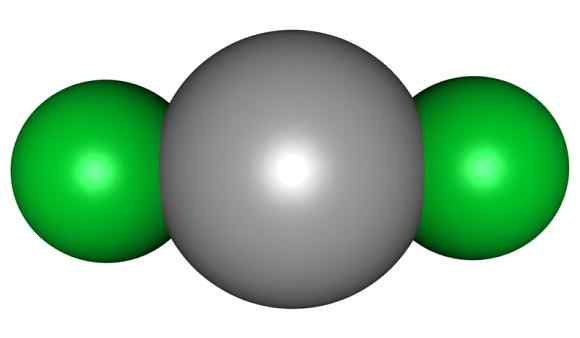 Molekul HGCL2. Abu -abu = merkuri; Hijau = klorin. Arrowsmaster / domain publik. Sumber: Wikimedia Commons.
Molekul HGCL2. Abu -abu = merkuri; Hijau = klorin. Arrowsmaster / domain publik. Sumber: Wikimedia Commons. Ini berarti bahwa dalam gelas senyawa tersebut mempertahankan struktur molekulnya CL-HG-CL di mana jarak HG-Cl mirip dengan saat berada dalam keadaan gas, sedangkan di kaca jarak dengan atom klorin dari molekul lain banyak tua.
 Pengaturan molekul HGCL2 Di gelas. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons.
Pengaturan molekul HGCL2 Di gelas. Benjah-bmm27 / domain publik. Sumber: Wikimedia Commons. Dalam keadaan gas jelas molekuler dan juga dalam larutan berair.
Tata nama
- Merkurius klorida (II)
- Merkuri klorida
- Merkuri Bichloride
- Dicloromercurio
Properti
Keadaan fisik
Kristal kristal putih, kristal rombik.
 Merkuri klorida padat. Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons.
Merkuri klorida padat. Leiem/cc by-sa (https: // createveCommons.Org/lisensi/by-sa/4.0). Sumber: Wikimedia Commons. Berat molekul
271,5 g/mol
Titik lebur
280 ºC
Titik sublimasi
Pada 300 ° C Sublima, yaitu, itu langsung dari padatan gas.
Kepadatan
5.6 g/cm3
Kelarutan
Little Water Soluble: 7.31 g/100 ml pada 25 ° C. Alkohol larut: 33 g/ 100 ml pada 25 ° C. Etil asetat larut. Sedikit larut dalam eter: 4 g/100 ml. Sesuatu yang larut dalam benzena.
Itu dapat melayani Anda: Helmholtz Free Energy: Unit, bagaimana itu dihitung, latihan terpecahkanph
Solusi 0,2 mol/L memiliki pH 3,2-4,7.
Sifat kimia
Dalam larutan berair ada hampir secara eksklusif (∼ 99%) dalam bentuk molekul HGCL2. Namun, ia menderita hidrolisis:
Hgcl2 + H2Atau ⇔ hg (OH) cl + h+ + Cl-
Hgcl2 + 2 h2Atau ⇔ hg (oh)2 + 2 h+ + 2 Cl-,
Ini menyajikan kelarutan yang nyata dalam pelarut organik, di mana ia mengambil bentuk dimer, yaitu dua molekul terikat.
Di hadapan bahan organik dan dengan aksi sinar matahari itu dikurangi membentuk merkuri klorida (I) (HGCL) dan kemudian merkuri logam.
Hgcl2 + Sinar matahari → hgcl → hg0
Dengan larutan natrium hidroksida (NaOH) menghasilkan endapan kuning pra -kuning (HGO).
Ini tidak kompatibel atau bereaksi dengan bentuk, sulfit, fosfat, sulfida, gelatin, albumin, alkalis, amonia, kalsium hidroksida, bromida, karbonat, besi, tembaga, timbal, garam perak dan beberapa bahan tanaman.
Properti lainnya
Karena di antara hal -hal lain hingga kovalennya dari karakter ionik, itu sedikit mudah menguap pada suhu kamar dan cukup menguap pada suhu 100 ° C.
Memperoleh
Anda dapat menyiapkan merkuri logam pengoksidasi (HG0) dengan gas klor (CL2). Saat memanaskan dan mencapai lebih dari 300 ° C, nyala api muncul dan uap yang dikumpulkan disublimasikan, dan ketika kristal HGCL terbentuk2.
HG + Cl2 + Panas → HGCL2
Ini juga diperoleh dengan memanaskan merkuri sulfat (II) kering dengan natrium klorida. Uap HGCL2 Subliman itu dikumpulkan dan kental menjadi padatan kristal.
Hgso4 + 2 NaCl → HGCL2 + Na2Sw4
Reaksi antara merkuri oksida (II) dengan asam klorida dalam jumlah stoikiometrik menghasilkan kristal HGCL2 Saat medium didinginkan.
HGO + 2 HCL → HGCL2 + H2SALAH SATU
Kristal dapat dimurnikan dengan rekristalisasi dan sublimasi.
Aplikasi
Di laboratorium kimia
Ini digunakan sebagai reagen dalam berbagai analisis kimia. Ini memungkinkan persiapan senyawa merkuri lainnya, seperti merkuri iodida (II), merkuri oksida (II), merkuri klorida (I), amonium dan merkuri klorida (II).
Dapat melayani Anda: fluoride: riwayat, sifat, struktur, memperoleh, risiko, penggunaanDi laboratorium patologi
Ini adalah bagian dari larutan asetat zenker, yang digunakan untuk mengobati sampel atau spesimen biopsi sumsum tulang. Jaringan dengan cepat diatur dengan detail histologis yang sangat baik untuk diamati dengan mikroskop.
 Terkadang hgcl2 Ini digunakan di laboratorium patologi. Penulis: Ernesto Eslava. Sumber: Pixabay.
Terkadang hgcl2 Ini digunakan di laboratorium patologi. Penulis: Ernesto Eslava. Sumber: Pixabay. Penggunaan yang ditinggalkan
Di abad pertengahan dan sampai awal XX digunakan dalam berbagai aplikasi, karena efek berbahaya bagi kesehatan tidak diketahui.
- Sebagai pengobatan penyakit tertentu, antiseptik topikal dan desinfektan.
 Di masa lalu HGCL2 Itu digunakan untuk mengobati sifilis. G. H. Rubah / domain publik. Sumber: Wikimedia Commons.
Di masa lalu HGCL2 Itu digunakan untuk mengobati sifilis. G. H. Rubah / domain publik. Sumber: Wikimedia Commons. - Dalam kedokteran hewan sebagai agen kaustik, desinfektan dan antiseptik.
- Di bidang pertanian ia bertindak sebagai fungisida, untuk mengendalikan cacing tanah, seperti insektisida dan penolak kecoak, semut dan rayap, dan sebagai desinfektan untuk melindungi benih dan umbi.
- Untuk konservasi kayu, agen kimia untuk membalih dan menghemat sampel anatomi.
- Sebagai katalis dalam mendapatkan vinil klorida dari asetilena.
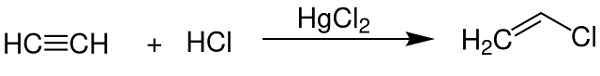 Merkurius klorida (II) berfungsi sebagai katalis dalam mendapatkan beberapa senyawa kimia. Chem Sim 2001 / Domain Publik. Sumber: Wikimedia Commons.
Merkurius klorida (II) berfungsi sebagai katalis dalam mendapatkan beberapa senyawa kimia. Chem Sim 2001 / Domain Publik. Sumber: Wikimedia Commons. - Dalam elektroda aluminium.
- Untuk menandai besi dan baja.
- Sebagai reagen fotografi.
- Dalam pencetakan kain, sebagai mordan untuk kelinci dan bulu kastor, untuk pewarna kayu.
- Sebagai komponen baterai kering.
Risiko
Untuk kesehatan
Itu adalah senyawa yang korosif dan sangat beracun jika dicerna, karena dapat menyebabkan kematian. Menyerang saluran pencernaan dan sistem ginjal. Menyebabkan luka bakar yang parah pada kulit dan mata.
Paparan yang berkepanjangan atau berulang terhadap senyawa ini menyebabkan kerusakan pada organ internal. Semua bentuk merkuri beracun dan HGCL2 adalah salah satu yang paling beracun.
Diduga karsinogen, yang menyebabkan cacat genetik dan kerusakan kesuburan.
Bahaya kebakaran
Meskipun tidak bisa meledak saat menerapkan panas. Saat itu memecah gas beracun dan merkuri.
Campuran HGCL2 Dengan logam alkali seperti natrium atau kalium mereka sangat sensitif terhadap pukulan dan dapat dieksploitasi dengan dampaknya. Jika Anda bersentuhan dengan amonia, sulfida, asam oksalat dan asetilena juga dapat meledak.
Dapat melayani Anda: asam klorida (HCl)Efek pada lingkungan
Ini sangat beracun bagi organisme akuatik dan darat, efeknya bertahan dari waktu ke waktu. Itu dapat menghadirkan bioakumulasi di seluruh rantai makanan, baik pada tanaman maupun hewan.
 Merkuri klorida tidak boleh dibuang di lingkungan. Penulis: Naadjuuh. Sumber: Wikimedia Commons.
Merkuri klorida tidak boleh dibuang di lingkungan. Penulis: Naadjuuh. Sumber: Wikimedia Commons. Itu mempengaruhi pernapasan, fotosintesis dan jalur metabolisme tanaman lainnya yang menyebabkan kerusakannya. Disposisi di lingkungan (baik air maupun tanah maupun atmosfer) tidak boleh terpengaruh).
Kehadiran berbahaya di beberapa solusi alami
Terlepas dari toksisitasnya, ada obat alami dan ramuan yang mengandungnya, jadi orang, tanpa menyadarinya, terpapar dengan senyawa ini.
Misalnya, dalam pengobatan tradisional Calomel atau Qing Fen mengandung beberapa HGCL2. Ini adalah obat yang digunakan sebagai diuretik, antiseptik, salep kulit, pencahar dan diterapkan secara eksternal untuk ketidaknyamanan gigi pada anak -anak.
 Beberapa obat alami yang tidak dikendalikan dapat mengandung HGCL2. Penulis: Beings Silvija. Sumber: Pixabay.
Beberapa obat alami yang tidak dikendalikan dapat mengandung HGCL2. Penulis: Beings Silvija. Sumber: Pixabay. Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Merkuri klorida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Lester, s.C. (2010). Pemrosesan spesimen. Zenker's Acetic Fixative (Orange). Dalam Manual of Surgical Patology (Edisi Ketiga). Pulih dari scientedirect.com.
- Clarksson, t.W. (2001). Agen. Sifat fisik dan kimia. Dalam Buku Pegangan Toksikologi Peticid (Edisi Kedua). Pulih dari scientedirect.com.
- Fretham, s.J.B. et al. (2015). Merkuri dan neurodegenerasi. Obat alami dan ramuan yang mengandung HG. Dalam nutraceutical bioaktif dan suplemen makanan pada penyakit neurogis dan otak. Pulih dari scientedirect.com.
- Knight, s. et al. (2014). Distribusi dan kelimpahan tanaman air - dampak manusia. Polutan Kimia. Dalam modulasi referensi dalam sistem bumi dan ilmu lingkungan. Pulih dari scientedirect.com.
- Timah, d.R. (Editor) (2003). Buku Pegangan Kimia dan Fisika CRC. 85th CRC Press.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Ciavatta, l. dan grimaldi, m. (1968). Hidrolisis merkuri (II) klorida, HGCL2. Jurnal Kimia Anorganik dan Nuklir, Volume 30, Edisi 2, Februari 1968, Halaman 563-581. Pulih dari scientedirect.com.
- Wikimedia Foundation (2020). Merkuri (ii) klorida. Diterima dari.Wikipedia.org.
- « 21 Ilmuwan Meksiko dan kontribusi historisnya
- Struktur Merkurius Fulminat, Properti, Memperoleh, Penggunaan »

