Fundamental, Jenis, Aplikasi Coulombimetry

- 3673
- 993
- Frederick Pfeffer
Itu Coulombimetry Ini adalah teknik analisis elektrokimia yang terdiri dari melakukan elektrolisis lengkap, sehingga analit dapat dikuantifikasi; yaitu, untuk menentukan konsentrasi analit dalam masalah masalah melalui oksidasi atau reduksi lengkapnya. Ini, tidak seperti potensiometri, teknik dinamis, karena arus dibiarkan mengalir secara bebas melalui sel -sel elektrokimia.
Seperti namanya, muatan listrik Q, dalam unit Coulomb, C, diukur dan berkorelasi dengan konsentrasi analit teroksidasi atau berkurang di pinggiran elektroda. Oleh karena itu, keadaan oksidasi perubahan analit, terjadi dalam proses transfer dan penyerapan elektron yang memungkinkan perhitungan stoikiometri dari konsentrasi yang diinginkan.
 Perakitan dasar untuk elektrolisis di mana beberapa spesies berwarna -warni terbentuk karena pH dan kompleksasi rimbawan yang ada. Sumber: Steve Jurvetson dari Menlo Park, USA, CC oleh 2.0, via Wikimedia Commons
Perakitan dasar untuk elektrolisis di mana beberapa spesies berwarna -warni terbentuk karena pH dan kompleksasi rimbawan yang ada. Sumber: Steve Jurvetson dari Menlo Park, USA, CC oleh 2.0, via Wikimedia Commons Dalam Coulombimetry, baterai atau potensiostat digunakan untuk mengontrol arus atau potensial yang diterapkan pada sel. Sel -sel ini, tidak seperti potensiometrik, terdiri dari sistem tiga elektroda, dan dilengkapi dengan voltmeter dan ammeter.
Coulombimetry menyajikan keuntungan karena dapat melakukan derajat tanpa menyiapkan atau menstandarisasi pola. Ini juga memungkinkan mengukur jumlah analit yang sangat kecil dan terbatas, seperti kation logam, senyawa anorganik dan senyawa organik. Misalnya, ada coulometer yang dirancang khusus untuk mengukur CO2 Dissolved dalam sampel dari lautan.
Teknik ini menawarkan rute analitik yang berbeda dari volumetrik dan potensiometrik, begitu banyak analisis, tergantung pada sifat elektrokimia analit, dapat mengembangkan coulombimetri secara.
Dasar teoritis dari coulombimetry
Hukum Faraday
Coulombimetry didasarkan pada hukum Faraday, yang menetapkan hubungan antara muatan listrik sel elektrokimia dan jumlah analit yang mengoksidasi atau mengurangi. Mengetahui beban ini Q, serta beban elektron (1.6 · 10-19 C), Anda dapat menghitung jumlah elektron yang terlibat dalam suatu reaksi, NDan-:
NDan- = Q/E
Di sisi lain, diketahui bahwa satu mol elektron (6.02 · 1023) Porta muatan listrik yang sama dengan 96485 C, sosok yang dikenal sebagai Faraday Constant:
F = diKE
= 96485.3365 c/mol
Menjadi nyaman untuk mengekspresikan jumlah elektron tergantung pada mol. Berkat ini, koefisien stoikiometrik dari reaksi elektrokimia dapat digunakan, menjadi oksidasi atau reduksi, dengan mempertimbangkan berapa banyak mol elektron yang menang atau kehilangan spesies.
Dapat melayani Anda: natrium fosfat: struktur, sifat, sintesis, penggunaanPerhitungan Dasar
Misalnya, pertimbangkan persamaan kimia berikut:
Sapi + 2e- → Jaringan
Mengukur bahwa ketika seluruh spesies sapi telah direduksi menjadi jaringan, kita dapat menghitung mol sapi menggunakan faktor konversi:
xq · (mol e- /96485.3365 c) · (Mol Ox/ 2mol E-) = Mol Ox
Yaitu, seperti yang kita ketahui muatan listrik untuk mol elektron, kita akan memiliki berapa banyak elektron yang sesuai dengan beban xq. Tetapi pada gilirannya, setiap 2 mol elektron ini digunakan untuk mengoksidasi 1 mol sapi.
Alasan ini menyebabkan formula langsung, bahkan jika tidak disarankan untuk menghafalnya, tetapi untuk dapat menyimpulkannya seperti yang dilakukan:
N = Q/(fNDan-)
Di mana NDan- Itu adalah jumlah mol elektron dalam persamaan kimia.
Asalkan dapat dihitung Q, terlepas dari jenis coulombimetry, mol sapi atau analit jaringan dapat ditentukan; Selama, efisiensi arus adalah 100%. Yang terakhir berarti bahwa semua beban yang harus menjadi produk dari hanya satu transformasi, tanpa spesies lain dikurangi atau dioksidasi.
Yayasan Eksperimental Coulombimetry
Sel
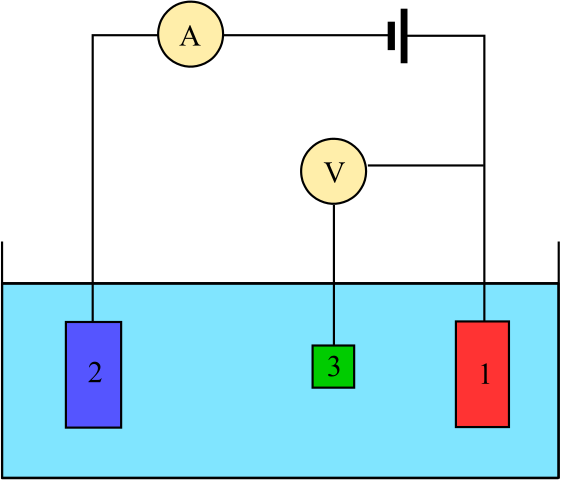 Diagram untuk sel elektrokimia yang terdiri dari tiga elektroda: referensi (3), asisten (2) dan pekerjaan (1). Sumber: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons
Diagram untuk sel elektrokimia yang terdiri dari tiga elektroda: referensi (3), asisten (2) dan pekerjaan (1). Sumber: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons Up kami memiliki diagram untuk sel dengan tiga elektroda, yang biasanya digunakan dalam analisis coulombimetri. Reaksi redoks terjadi di antara elektroda kerja (1) dan bantu (2). Di antara mereka berdua menghubungkan baterai, untuk menerapkan potensi ke sel, dan ammeter (a), untuk mengukur arus listrik.
Namun, elektroda referensi (3) diperlukan untuk dapat memantau potensi elektroda kerja, dan dengan demikian mengetahui variasi potensi elektroda tambahan. Dengan cara ini, potensi seluruh sel dapat ditentukan, dansel, diperlukan untuk memperkirakan akhir reaksi redoks di salah satu jenis coulombimetri.
Perhatikan bahwa antara elektroda kerja dan elektroda referensi hampir tidak mengalir arus karena voltmeter impedansi tinggi (v), berkat pembacaan potensi elektroda kerja kerja. Di antara kedua elektroda ini, kami memiliki sistem yang mirip dengan analisis potensiometri: ini statis dan tidak dinamis.
Ini dapat melayani Anda: Kimia Nuklir: Sejarah, Bidang Studi, Bidang, AplikasiPotensi
Coulombimetry, jadi untuk berbicara, elektrolisis yang dilakukan untuk tujuan analitik dan kuantitatif. Oleh karena itu, ada pembicaraan tentang menerapkan potensi eksternal, dipasok oleh baterai, untuk melakukan reaksi elektrokimia non -spontan; yaitu mereka yang memiliki potensi negatif.
Pertimbangkan, misalnya, reaksi berikut disertai dengan standar potensial masing -masing:
Cu2+ + 2e- ⇌ Cu (S) Eºkisi = +0.337 v
H2Atau ⇌ 1/2o2(g) + 2h+ + 2e- Eºkisi = +1.230 v
Menjadi persamaan reaksi global sama dengan:
Cu2+ + H2Atau ⇌ cu (s) + 1/2o2(g) + 2h+ Eºkisi = -0.893 v
Baterai harus menerapkan potensi 0.893 V sehingga elektroda tembaga dan pembentukan ion hidrogen dimungkinkan. Potensi ini adalah esel. Namun, dalam praktiknya, potensi yang lebih besar dari yang dihitung harus diterapkan, karena ada potensi yang menentang evolusi reaksi:
DANsel = Ekatoda - DANanoda - OP - IR - CP
Di mana,
OP: Overpotensial (penghalang kinetik)
IR: Ohmic (potensi intrinsik untuk sel)
CP: Polarisasi konsentrasi (produk penurunan Cu2+)
Jenis Coulombimetry
Ada tiga jenis coulombimetri: amperostatik, potensiostatic, dan elektrografi elektrografi elektrografi.
Amperostatik atau galvanostatik
Dalam jenis coulombimetry ini, arus yang berjalan melalui sel adalah konstan dengan menggunakan amperostat. Oleh karena itu, memiliki arus yo Berkat pembacaan ammeter, dan juga mengetahui waktu T Setelah elektrolisis berakhir, kita dapat menghitung beban yang terkait dengan transformasi analit:
Q = Barang
Konsekuensi dari menjaga konstanta saat ini adalah bahwa elektroda potensial potensial, baik secara positif maupun negatif. Variasi mendadak ini menunjukkan bahwa analit telah sepenuhnya bereaksi, yaitu ketika elektrolisis berhenti dan diukur T. Ini adalah dasar untuk derajat koulometrik.
Jika potensi berlanjut atau mengunggah, spesies elektroaktif lainnya yang tidak diinginkan akan berakhir bereaksi. Itulah sebabnya potensi yang terkait dengan transformasi yang menarik harus diketahui dengan sempurna.
Potensiostatik
Salah satu cara untuk mencegah spesies lain. Di sinilah potensiosotik coulombimetry masuk, karena menggunakan potentiostete untuk menetapkan potensi tertentu untuk sel. Tidak seperti coulombimetri amperostatik, sekarang saat ini yang berubah seiring berjalannya waktu.
Dapat melayani Anda: toluena: struktur, sifat, penggunaan, mendapatkanKarena konfigurasi teknis ini, kami tidak dapat menghitungnya secara langsung dengan nilai -nilai yo Dan T; Saat ini berkurang dari waktu ke waktu. Ini karena seperti yang bereaksi analit, akan ada lebih sedikit dan lebih sedikit molekul atau atom yang menyumbang atau menerima elektron. Oleh karena itu, yang sama dengan area integral di bawah kurva grafik yo Vs T.
Elektrografi
Elektrografi coulombimetry, hanya dikenal sebagai electrogravimetry, adalah elektrolisis di mana tidak perlu mengukur beban atau arus listrik. Sebaliknya, massa elektroda diukur sebelum dan sesudah elektrolisis.
Teknik ini hanya berlaku ketika spesies yang dikurangi adalah kation logam yang elektrodepos pada elektroda, membuatnya lebih berat.
Aplikasi
Potensiostetik
Analisis potensiostetik memungkinkan untuk mengurangi atau mengoksidasi secara selektif satu spesies pada satu waktu di tengah campuran. Misalnya, mereka digunakan untuk menentukan konsentrasi ion anorganik berikut dalam jumlah jejak, atau dalam matriks yang kompleks:
-Cu2+
-Kartu as3+
-CD2+
-Bersama2+
-Keyakinan2+ dan iman3+
-Pb2+
-X (f-, Cl-, Br- dan saya-)
-Juga tidak2+
-Pu3+
-Ag+
-Sn2+
-Zn2+
-ATAU6+
Juga, analisis ini dapat digunakan untuk menentukan komposisi paduan. Setelah paduan asam dilarutkan, potensi sel diterapkan dengan cara yang terhuyung dan terkontrol, sehingga menentukan jumlah yang dikurangi untuk setiap kation logam yang mengintegrasikannya.
Gelar Coulometrik
Dalam derajat koulometrik, agen mediasi digunakan yang memastikan untuk sepenuhnya menetralisir atau bereaksi dengan analit yang tersisa. Tujuan dari ini adalah untuk mencegah variasi potensial, ke arus konstan, berasal dalam reaksi agunan. Dengan demikian, adalah pemegang yang mungkin, misalnya, asam askorbat menggunakan yodium sebagai mediator.
Beberapa kation logam, seperti AG+, Ec3+, Keyakinan3+, M N2+, Anda3+, Cr2+, Mereka juga dapat ditentukan oleh derajat ini.
Di sisi lain, reaksi asam-basa masih dapat menggunakan teknik ini, karena potensi besar menyebabkan air menjadi ionik3SALAH SATU+ Atau oh-, yang melayani dari agen judul yang dihasilkan in situ; yaitu, mereka akan menetralkan asam atau basa yang ada.
CO2 dari lautan, reaksi presipitasi, dan pembentukan kompleks dengan EDTA, juga dimungkinkan untuk menganalisisnya dengan menerapkan derajat koulometrik, di mana indikator redoks ditambahkan untuk menyoroti titik akhir elektrolisis.
Referensi
- Hari, r., & Underwood, a. (1986). Kimia analitik kuantitatif (Edisi kelima.). Pearson Prentice Hall.
- Skoog d.KE., Barat d.M. (1986). Analisis instrumental. (Ed kedua.). Inter -American., Meksiko.
- Kata. Doug Stewart. (2020). Definisi Coulometry. Pulih dari: chemicool.com
- Wikipedia. (2020). Coulometry. Diperoleh dari: di.Wikipedia.org
- Harvey David. (5 Juni 2019). Metode Coulometrik. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- « Kerangka Metodologis Cara Menulisnya, Struktur, Contoh
- Filsafat Filsafat Kontemporer, Karakteristik, Arus, Penulis »

