Chrome (CR)

- 2336
- 42
- Ernesto Mueller
 Chrome adalah logam yang sangat reaktif. Wikimedia Commons
Chrome adalah logam yang sangat reaktif. Wikimedia Commons Apa itu Chrome?
Dia chrome (Cr) adalah elemen kimia dari grup 6 (vib) dari tabel periodik. Setiap tahun berton -ton logam ini diproduksi oleh ekstraksi kromit atau mineral magnesium (FECR2SALAH SATU4, Mgcr2SALAH SATU4), yang dikurangi dengan batubara untuk mendapatkan logam. Itu sangat reaktif, dan hanya dalam kondisi yang sangat reduksi itu dalam bentuk murni.
Mineral dan oksida, serta bagian tembaga logam kecil, membuat elemen ini menempati nomor 22 dari korteks Bumi yang paling melimpah.
Chromium Chemistry sangat beragam karena dapat membentuk tautan dengan hampir seluruh tabel periodik. Masing -masing senyawa menunjukkan warna yang bergantung pada bilangan oksidasi, serta spesies yang berinteraksi dengannya.
Juga, bentuk tautan ke karbon, campur tangan dalam sejumlah besar senyawa organomethalic.
Karakteristik dan sifat krom
Kromium adalah logam perak dalam bentuk murni, dengan bilangan atom 24 dan berat molekul sekitar 52 g/mol (52CR, isotopnya yang paling stabil).
Mengingat tautan logamnya yang kuat, ia menyajikan titik fusi (1907 ºC) dan mendidih (2671 ºC) tinggi. Juga, struktur kristalnya membuatnya menjadi logam yang sangat padat (7.19 g/ml).
Itu tidak bereaksi dengan air untuk membentuk hidroksida, tetapi dengan asam. Ini teroksidasi dengan oksigen udara yang umumnya menghasilkan oksida krom, yang merupakan pigmen hijau yang banyak digunakan.
Lapisan oksida ini menciptakan apa yang dikenal sebagai Pasifan, Melindungi logam dari korosi berikutnya, karena oksigen tidak dapat menembus sinus logam.
Konfigurasi elektroniknya adalah [ar] 4s13d5, Dengan semua elektron yang hilang, dan oleh karena itu, ini menunjukkan sifat paramagnetik. Namun, perkawinan spin elektronik dapat terjadi jika logam mengalami suhu rendah, memperoleh sifat lain, seperti antiferromagnetisme.
Dapat melayani Anda: bahan refraktoriStruktur chrome kimia
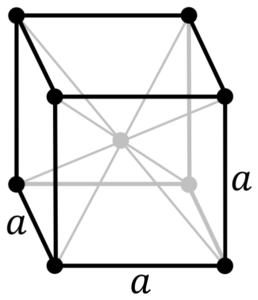 Struktur logam krom. Sumber: Oleh PNG asli oleh Daniel Mayer, Drbob, Wikimedia Commons
Struktur logam krom. Sumber: Oleh PNG asli oleh Daniel Mayer, Drbob, Wikimedia Commons Apa struktur logam krom? Dalam bentuk murni, kromium mengadopsi struktur kristal kubik yang berpusat pada tubuh (CC atau BCC). Ini berarti bahwa atom krom terletak di tengah kubus, yang ujungnya ditempati oleh krom lain (seperti pada gambar superior).
Struktur ini bertanggung jawab atas krom yang memiliki titik pencairan dan mendidih yang tinggi, serta kekerasan yang hebat. Atom tembaga tumpang tindih orbital S dan D untuk membentuk pita penggerak menurut teori band.
Dengan demikian, kedua pita penuh dalam dua karena konfigurasi elektroniknya adalah [ar] 4s13d5, Dan sebagai orbital S, dapat menampung dua elektron, dan orbital sepuluh. Kemudian, hanya setengah dari pita yang dibentuk oleh tumpang tindih yang ditempati oleh elektron.
Dengan dua perspektif ini -struktur kristal dan tautan logam -banyak dari sifat fisik logam ini dapat dijelaskan secara teori. Namun, tidak ada yang menjelaskan mengapa Chrome dapat memiliki beberapa keadaan atau angka oksidasi.
Untuk ini, pemahaman yang mendalam tentang stabilitas atom sehubungan dengan spin elektronik.
Nomor oksidasi krom
Karena konfigurasi elektronik chrome adalah [ar] 4s13d5 Anda dapat menang hingga satu atau dua elektron (CR1- dan cr2-), atau kehilangan mereka untuk memperoleh angka oksidasi yang berbeda.
Jadi, jika krom kehilangan elektron, itu akan menjadi [ar] 4s03d5; Jika Anda kehilangan tiga, [ar] 4s03d3; Dan jika Anda kehilangan semuanya, [ar], atau apa yang sama, itu akan menjadi isolektronik untuk argon.
Dapat melayani Anda: titik didih: konsep, perhitungan, dan contohKromium tidak kehilangan atau mendapatkan elektron karena kemauan belaka: harus ada spesies yang melakukan atau menerimanya untuk beralih dari satu nomor oksidasi ke nomor lainnya.
Kromium memiliki angka oksidasi berikut: -2, -1, 0, +1, +2, +3, +4, +5 dan +6. Dari mereka +3, cr3+, Ini adalah yang paling stabil dan karena itu dominan dari semua; diikuti oleh +6, cr6+.
Penggunaan Chrome
Sebagai pewarna atau pigmen
Kromium memiliki berbagai aplikasi, dari pewarna untuk berbagai jenis kain, hingga pelindung yang mempercantik bagian logam, dalam apa yang dikenal sebagai krom, yang dapat dilakukan dengan logam murni, atau dengan senyawa cr (iii) atau cr atau cr (Vi).
Cromic Fluoruro (CRF3), misalnya, digunakan sebagai pewarna untuk kain wol; Cromic sulfat (CR2(SW4)3), ditakdirkan untuk mewarnai enamel, keramik, lukisan, tinta, pernis, dan juga berfungsi untuk logam kromar; dan chromic oxide (CR2SALAH SATU3) Juga menemukan penggunaan di mana warna hijau yang menarik diperlukan.
Oleh karena itu, setiap mineral chrome dengan warna yang intens dapat ditakdirkan untuk mewarnai struktur, tetapi setelah itu fakta apakah senyawa ini berbahaya atau tidak untuk lingkungan atau untuk kesehatan individu.
Faktanya, sifat beracunnya digunakan untuk menghemat permukaan kayu dan serangan serangga lainnya.
Di chrome atau metalurgi
Demikian juga, sejumlah kecil krom ke baja ditambahkan untuk memperkuatnya di hadapan oksidasi dan untuk meningkatkan kecerahannya. Ini karena mampu membentuk karbida abu -abu (CR3C2) Sangat tahan saat bereaksi dengan oksigen udara.
Dapat melayani Anda: kalsium hidroksida (ca (oh) 2): struktur, sifat, mendapatkan, menggunakanKarena chrome dapat memoles sampai permukaan yang cerah, chrome kemudian menyajikan desain perak dan warna sebagai alternatif yang lebih murah untuk tujuan ini.
Nutrisi
Beberapa perdebatan jika kromium dapat dianggap sebagai elemen penting, yaitu, sangat diperlukan dalam diet harian. Ini ada dalam beberapa makanan dalam konsentrasi yang sangat kecil, seperti daun hijau dan tomat.
Ada juga suplemen protein yang mengatur aktivitas insulin dan mendukung pertumbuhan otot, seperti halnya dengan polinikotinato krom.
Dimana kromnya?
Kromium ditemukan dalam berbagai macam mineral dan permata, seperti rubi dan zamrud. Mineral utama dari mana krom diekstraksi adalah krom (mcr2SALAH SATU4), Di mana m dapat berupa logam lain yang terkait dengan kromium oksida. Tambang ini berlimpah di Afrika Selatan, di India, Turki, Finlandia, Brasil dan negara -negara lain.
Setiap sumber memiliki satu atau lebih varian kromit. Dengan cara ini, untuk setiap M (Faith, Mg, Mn, Zn, dll.) Mineral krom yang berbeda muncul.
Untuk mengekstrak logam itu perlu. Ini dilakukan dengan karbon atau aluminium:
Fecr2SALAH SATU4 + 4c => fe + 2cr + 4co
Demikian juga, Chromita ditemukan (PBCRO4).
Biasanya, dalam mineral mana pun di mana ion cr3+ dapat menggantikan al3+, Keduanya dengan radio ionik yang sedikit mirip, merupakan pengotor yang menghasilkan sumber alami lain dari logam yang menakjubkan namun berbahaya ini.
Referensi
- Tenebaum e. Kromium. Diambil dari: Kimia.Pomona.Edu
- Libretteks Kimia. Kimia kromium. Diambil dari: chem.Librettexts.org
- Kromium. Diambil dari: chemistryxplaed.com

