Apa elemen paling elektronegatif dan mengapa?

- 4005
- 334
- Mr. Darrell Streich
 Elemen paling elektronegatif adalah fluoride (f), terkunci di lingkaran merah
Elemen paling elektronegatif adalah fluoride (f), terkunci di lingkaran merah Dia lebih banyak elemen elektronegatif Dalam tabel periodik itu adalah fluor, yang kimianya adalah F dan milik kelompok halogen. Di antara semua elemen tabel periodik, fluoride adalah yang paling cemas untuk menangkap elektron dari atom lain.
Elemen ini, gas pada suhu kamar, sangat reaktif dan oleh karena itu tidak mudah untuk menemukannya dalam keadaan murni di alam. Fluor dengan mudah dihubungkan dengan elemen lain seperti sulfur, kalsium dan logam, serta banyak senyawa, terutama yang mengandung hidrogen.
Elektronegativitasnya yang tinggi memungkinkan Anda bahkan menggabungkan dengan gas mulia seperti Xenon, Kripton dan Radon.
Setelah fluor, oksigen adalah elemen kedua dengan elektronegativitas tertinggi. Sebaliknya, elemen dengan elektronegativitas terendah adalah Francio (FR) dan Cesium (CS).
 Karena itu adalah elemen paling elektronegatif, fluor membentuk banyak senyawa, seperti fluorit, atau kalsium fluorida. Sumber: Wikimedia Commons
Karena itu adalah elemen paling elektronegatif, fluor membentuk banyak senyawa, seperti fluorit, atau kalsium fluorida. Sumber: Wikimedia Commons Oleh karena itu, ini adalah yang paling elektropositif Itu ada, meskipun Francio bersifat radioaktif dan sangat sedikit berlimpah.
Elektronegativitas dan tabel periodik
Skala elektronegativitas dikembangkan oleh ahli kimia dan hadiah Nobel Linus Pauling (1901-1994), meskipun konsepnya disebabkan oleh ahli kimia Swedia Job Jakob Berzelius (1779-1848).
Skala Pauling, yang memberikan nilai numerik dimensi ke elektronegativitas, digunakan untuk mengukur intensitas atom yang menarik elektron atom lain yang berbeda, dan dengan demikian membentuk tautan.
Setiap elemen memiliki elektronegativitas sendiri, yang tergantung pada sifat atomnya. Ini ditentukan secara eksperimental dan tidak langsung, misalnya, mengukur energi tautan, seperti yang dilakukan Pauling sekitar tahun 1932.
Pada skala Pauling Electronegativities, fluoride adalah yang pertama, dengan nilai perkiraan 3.98 ≈ 4.0.
Dapat melayani Anda: hidrokarbon alifatik: sifat, nomenklatur, reaksi, jenisElectronegativity adalah sifat periodik dari elemen. Dalam kebanyakan kasus (ada beberapa pengecualian), diamati bahwa elektronegativitas meningkat ketika bergerak dari kiri ke kanan melalui jajaran tabel periodik.
Dan juga, meningkat dari bawah ke atas, dengan bergerak di kolom.
 Tabel periodik elektronegativitas menurut skala Pauling. Fluor adalah elemen paling elektronegatif, terletak di atas dan di sebelah kanan, sedangkan Francio adalah yang paling elektronegatif dari semua, atau yang paling elektropositif, jika lebih disukai, dan berada di kolom kiri dan bawah. Sumber: f. Zapata.
Tabel periodik elektronegativitas menurut skala Pauling. Fluor adalah elemen paling elektronegatif, terletak di atas dan di sebelah kanan, sedangkan Francio adalah yang paling elektronegatif dari semua, atau yang paling elektropositif, jika lebih disukai, dan berada di kolom kiri dan bawah. Sumber: f. Zapata. Elektronegativitas fluor
Alasan bahwa fluor adalah elemen paling elektronegatif dalam tabel periodik, adalah karena konfigurasi elektroniknya (cara elektronnya diatur dalam orbital di sekitar nukleus).
Konfigurasi ini adalah 1s22s22 p5, Jadi fluoride memiliki 5 elektron di lapisan terluarnya.
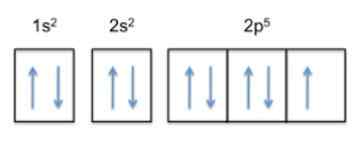
Sekarang, karena tren atom adalah untuk menyelesaikan lapisan luarnya, itu berarti bahwa fluor akan menerima elektron atom lain dengan sangat mudah, untuk mendapatkan stabilitas dan menyerupai gas mulia dari baris yang sama, yang merupakan neon , yang konfigurasi elektroniknya adalah 1s22s22 p6.
Atom fluor memiliki jari -jari yang sangat kecil, karena proton dalam nukleus mereka menarik elektron dengan sangat kuat, membuat mereka lebih dekat daripada di atom elemen elektronegatif yang kurang, seperti Cessium dan Francio.
Oleh karena itu, yang terakhir bersedia melepaskan elektron dengan mudah untuk membentuk tautan.
Referensi
- Aguilar, c. Panduan untuk Unit Pembelajaran Kimia I. Diperoleh dari: IPN.MX.
- Atkins, hlm. (2005). Prinsip Kimia, Jalan Penemuan. 3. Edisi. Editorial medis Pan -American.
- Clark, J. Elektronegivitas. Pulih dari: chem.Librettexts.org.
- Hein, m. (2014). Yayasan Kimia Perguruan Tinggi. Edisi ke -14. Wiley.
- Lentech. Elemen kimia yang dipesan oleh elektronegativitasnya. Pulih dari: lentech.adalah.

