Derivatif Terhalogenasi

- 1186
- 209
- Ray Thiel
Kami menjelaskan apa turunan terhalogenasi, sifatnya, penggunaan/aplikasi dan kami memberikan beberapa contoh
Turunannya yang terhalogenasi?
Itu Derivatif Terhalogenasi Mereka semua adalah senyawa yang memiliki atom halogen; yaitu, salah satu elemen kelompok 17 (f, cl, br, i). Elemen -elemen ini berbeda dari yang lain karena lebih elektronegatif, membentuk keragaman halida anorganik dan organik.
Gambar yang lebih rendah dari halogen ditampilkan di gambar yang lebih rendah. Dari atas ke bawah: fluoride (f2), Klorin (CL2), Bromo (br2) dan yodium (i2). Masing -masing memiliki kemampuan untuk bereaksi dengan sebagian besar elemen, termasuk antara congener dari kelompok yang sama (interhalogen).

Dengan demikian, turunan terhalogenasi memiliki formula mx jika itu adalah haluro logam, rx jika alkil dan arx jika aromatik. Dua terakhir terletak di kategori Haluros Organik. Stabilitas senyawa ini membutuhkan "manfaat" energi di depan molekul soda asli.
Sebagai aturan umum, fluoride terbentuk dialogenasi lebih stabil daripada yodium. Alasannya adalah karena perbedaan antara radio atom mereka (bola ungu lebih tebal daripada yang kuning).
Dengan meningkatkan jari -jari atom, tumpang tindih orbital antara halogen dan atom lainnya lebih buruk dan, oleh karena itu, tautannya lebih lemah.
Tata nama
Cara untuk menyebutkan senyawa ini dengan benar tergantung pada apakah mereka anorganik atau organik.
Anorganik
Halida logam terdiri dari ikatan, ionik atau kovalen, antara halogen X dan logam M (kelompok 1 dan 2, logam transisi, logam berat, dll.).
Dalam senyawa ini semua halogen memiliki keadaan oksidasi -1. Karena? Karena konfigurasinya Valencia adalah NS2Np5.
Oleh karena itu, mereka hanya perlu memenangkan satu elektron untuk menyelesaikan oktet Valencia, sementara logam teroksidasi, memberi mereka elektron yang mereka miliki.
Dapat melayani Anda: keseimbangan presisi: karakteristik, fungsi, bagian, penggunaanDengan demikian, fluoride tetap sebagai f-, fluor; Cl-, khlorida; BR-, bromida; dan i-, Saya terakhir. MF akan dinamai: fluoride (nama logam) (n), menjadi n valencia del metal hanya ketika memiliki lebih dari satu. Dalam kasus kelompok kelompok 1 dan 2, tidak perlu menyebutkan nama Valencia.
Contoh
- NAF: Sodium fluoride.
- CACL2: kalsium klorida.
- AGBR: perak bromida.
- Zni2: Seng Yoduro.
- CUCL: Tembaga klorida (I).
- CUCL2: tembaga klorida (II).
- Ticl4: Titanium chloride (IV) atau Titano tetrachloride.
Namun, elemen hidrogen dan non -logam - bahkan halogen yang sama - juga dapat membentuk haluros. Dalam kasus ini valencia dari No Metal tidak ditunjuk pada akhirnya:
- Pcl5: fosfor pentachloride.
- Bf3: Boro Trifluoruro.
- Ali3: Aluminium triyoduro.
- HBR: Hidrogen bromida.
- Jika7: yodium heptofluoride.
Organik
Terlepas dari apakah RX atau ARX, halogen secara kovalen terkait dengan atom karbon. Dalam kasus ini, halogen disebutkan dengan nama mereka, dan sisa nomenklatur tergantung pada struktur molekul R atau AR.
Untuk molekul organik paling sederhana, metana (Cho4), Turunan berikut diperoleh dengan mengganti H dengan Cl:
- Ch3CL: Klorometana.
- Ch2Cl2: Dichloromethane.
- Chcl3: tricyloromethane (kloroform).
- CCL4: Tetrachloromethane (karbon klorida (IV) atau karbon tetrachloride).
Di sini r terdiri dari satu atom karbon tunggal. Kemudian, untuk rantai alifatik lainnya (linear atau cabang) jumlah karbon dihitung dari mana ia terkait dengan halogen:
Ch3Ch2Ch2F: 1-fluorpropano.
Contoh sebelumnya adalah nilai alquilis primer. Jika rantai itu bercabang, yang terpanjang yang mengandung halogen dipilih dan mulai menghitung, meninggalkan ini sebagai angka yang mungkin:
Dapat melayani Anda: apa sifat fisik materi?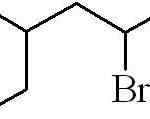
3-metil-5-bromoheksan
Dengan cara yang sama terjadi untuk substituen lain. Juga, untuk halida aromatik halogen ditunjuk dan kemudian sisa struktur:

Gambar superior menunjukkan senyawa yang disebut bromobenzene, menyoroti atom brom dalam coklat.
Sifat turunan terhalogenasi
Halida anorganik
Halida anorganik adalah padatan ionik atau molekul, meskipun yang pertama lebih banyak. Bergantung pada interaksi dan radio ionik MX, ini akan larut dalam air atau pelarut polar yang lebih sedikit lainnya.
Halida non -metalik (seperti boro) biasanya asam Lewis, yang berarti bahwa mereka menerima elektron untuk membentuk kompleks. Di sisi lain, halida (atau halogenuros) hidrogen terlarut dalam air menghasilkan apa yang dikenal sebagai hidrasida.
Titik lelehnya, mendidih atau sublimasi jatuh pada interaksi elektrostatik atau kovalen antara logam atau non -metal dengan halogen.
Demikian juga, radio ionik memainkan peran penting dalam sifat -sifat ini. Misalnya, jika m+ dan x- Mereka memiliki ukuran yang sama, kristal mereka akan lebih stabil.
Halida organik
Mereka kutub. Karena? Karena perbedaan dalam elektronegatif antara C dan halogen menciptakan momen kutub permanen dalam molekul. Juga, ini berkurang saat Grup 17 turun, dari tautan C-F ke C-I.
Tanpa mempertimbangkan struktur molekul R atau AR, angka halogen yang tumbuh secara langsung mempengaruhi titik didih, karena mereka meningkatkan massa molar dan interaksi antar molekul (RC-X-X-CR). Sebagian besar tidak dapat dimengerti dengan air, tetapi mereka dapat larut dalam pelarut organik.
Penggunaan turunan terhalogenasi
Penggunaan turunan terhalogenasi dapat memesan teks mereka sendiri. "Sahabat" molekuler dari halogen adalah faktor kunci, mengingat sifat dan reaktivitasnya menentukan penggunaan turunan.
Dapat melayani Anda: kalium sulfat (k2so4): struktur, sifat, penggunaan, sintesisDengan demikian, di antara keragaman besar penggunaan yang mungkin, yang berikut ini menonjol:
- Halogen molekuler digunakan untuk membuat umbi halogen, tempat Anda berhubungan dengan filamen tungsten pijar. Tujuan dari campuran ini adalah untuk bereaksi halogen x dengan tungsten yang diuapkan. Dengan cara ini deposisinya dihindari di permukaan bohlam, menjamin lebih banyak waktu hidup.
- Garam fluorur digunakan dalam fluorisasi perairan gigi dan pasta.
- Sodium dan kalsium hipoklorit adalah dua agen aktif dalam larutan pemutih komersial (klorin).
- Meskipun mereka memburuk lapisan ozon, klorofluorokarbon (CFC) digunakan dalam aerosol dan sistem pendingin.
- Vinyl chloride (cho2= CHCL) adalah monomer polyvinyl polimer klorida (PVC). Di sisi lain, Teflon, digunakan sebagai bahan non -stick, terdiri dari rantai polimer tetrafluorethylene (f2C = CF2).
- Mereka digunakan dalam kimia analitik dan sintesis organik untuk tujuan yang berbeda; Di antaranya, sintesis obat.
Contoh tambahan

Gambar superior menggambarkan hormon tiroid, yang bertanggung jawab untuk produksi panas serta peningkatan metabolisme umum dalam tubuh. Senyawa ini adalah contoh turunan terhalogenasi yang ada dalam tubuh manusia.
Di antara senyawa terhalogenasi lainnya, berikut ini disebutkan:
- Diclorodifenilriclorootan (DDT), insektisida yang efisien tetapi dengan dampak lingkungan yang serius.
- Timah klorida (snncl2), digunakan sebagai agen pereduksi.
- Chloroethane atau 1 chloroethane (ch3Ch2Cl), anestesi topikal yang bertindak dengan cepat mendinginkan kulit.
- Dichloroethylene (CLCH = CCLH) dan tetrachlorethylene (CL2C = CCL2), digunakan sebagai pelarut di industri pembersihan kering.
- « Struktur kimia silikon karbida, sifat dan penggunaan
- 80 frasa untuk cinta pertama yang tidak pernah lupa »

